Содержание
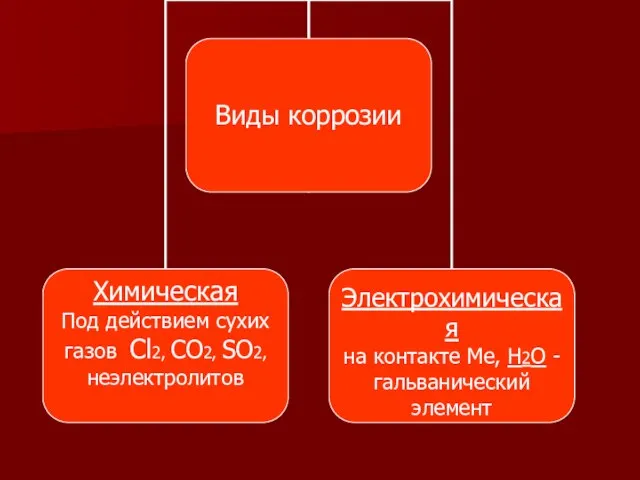
- 2. Коррозия – от лат. corrodere - разъедать
- 3. Ежегодно 1/4 всего произведенного Fe теряется из-за коррозии
- 5. Химически чистое железо не ржавеет, т.к. не содержит примесей Индия, Новый Дели, Железный столб 1 в
- 6. Примеры химической коррозии: Fe + O2 ? Fe3O4 Fe + Cl2 ? FeCl3 Cu ? CuO
- 7. 1813 г. Гемфри Деви открыл электрохимическую коррозию металлов
- 8. Электрохимическая коррозия железа Fe + O2 + H2O ? Fe(OH)3 Составить электронный баланс,указать окислитель и восстановитель,
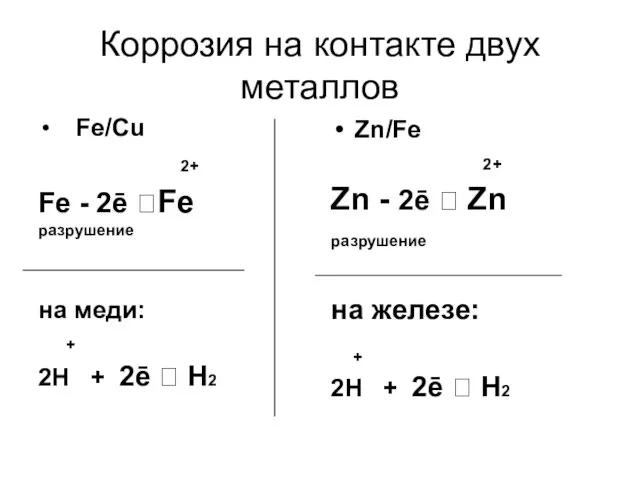
- 10. Коррозия на контакте двух металлов Fe/Cu 2+ Fe - 2ē ?Fe разрушение на меди: + 2Н
- 11. Защита от коррозии Защитное покрытие ( лак, масло, краска, покрытие некорродирующим металлом – Cr, Sn, Zn)
- 12. Защитное покрытие
- 13. Нержавеющая сталь
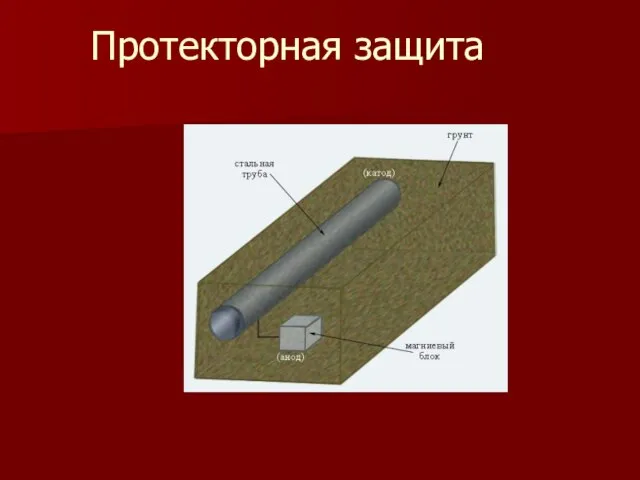
- 14. Протекторная защита
- 15. Вопросы Что такое коррозия? Какие виды коррозии существуют? Дайте определения. Почему не корродируют чистые металлы? Какой
- 16. Домашнее задание: § 10, выучить определения, упр.4,6 стр.51(устно)
- 18. Скачать презентацию












 Вермикулитовый концентрат
Вермикулитовый концентрат Неметаллы. Контрольная работа. 9 класс
Неметаллы. Контрольная работа. 9 класс Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Применение хидких кристалов в промышленности
Применение хидких кристалов в промышленности Презентация на тему Артур Конан-Дойл «Собака Баскервилей»
Презентация на тему Артур Конан-Дойл «Собака Баскервилей»  Соединения алюминия
Соединения алюминия Соли и их свойства
Соли и их свойства Неметаллы. 11 класс
Неметаллы. 11 класс Альдегиды. Кетоны
Альдегиды. Кетоны Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Плазменное состояние вещества
Плазменное состояние вещества Радиоактивные изотопы
Радиоактивные изотопы Пути использования активной уксусной кислоты
Пути использования активной уксусной кислоты Карбоновые кислоты
Карбоновые кислоты gidroliz_soley (1)
gidroliz_soley (1) Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Капиллярное поднятие жидкости
Капиллярное поднятие жидкости Презентация на тему Химия наука о веществах и их превращениях
Презентация на тему Химия наука о веществах и их превращениях  Карбонильные Соединения. Альдегиды и кетоны
Карбонильные Соединения. Альдегиды и кетоны Презентация на тему Благородные газы
Презентация на тему Благородные газы  Диффузия золота и свинца
Диффузия золота и свинца Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1) Минерал дунит
Минерал дунит Вода знакомая и не знакомая
Вода знакомая и не знакомая Химические реакции. Классификация
Химические реакции. Классификация Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» Обобщение темы «Неметаллы» (Подгруппа азота)
Обобщение темы «Неметаллы» (Подгруппа азота) Тренажер - Валентность. 8 класс
Тренажер - Валентность. 8 класс