Содержание
- 2. Судың диссоциациясы Н2О ↔ Н+ + ОН-
- 3. (Н2О) =1,8 ⋅10-9 , бұл дегеніміз судың 50 000 000 молекуласынан - 1 молекула диссоциацияланады:
- 4. КН2О = [Н+][ОН-] = = 1,8⋅10-16 ⋅ 55,56 = 10-14 [Н+]*[ОН-] =10-14 Сонда таза суда:
- 5. 1909 жылы Зеренсон терминдер енгізді сутектік көрсеткіш (рН) және гидроксильді көрсеткіш (рОН) СУДА: ОН ДА:
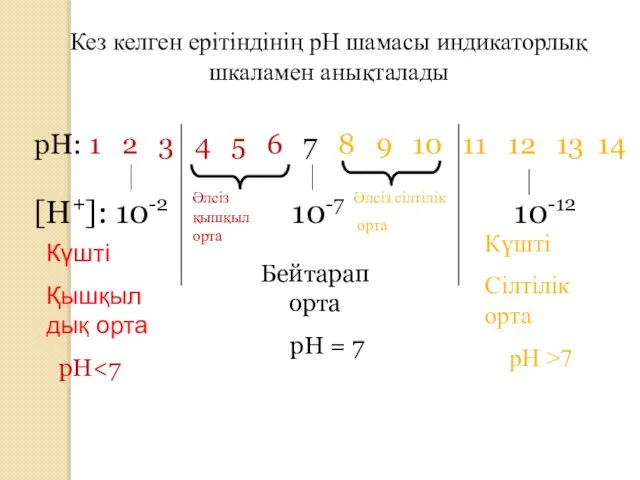
- 6. Сутектік көрсеткіш рН = - lg [Н+] рН – сутектік көрсеткіш рОН = - lg [ОН-]
- 7. рН = 7 нейтралды орта рН рН > 7 сілтілі орта
- 8. Кез келген ерітіндінің рН шамасы индикаторлық шкаламен анықталады
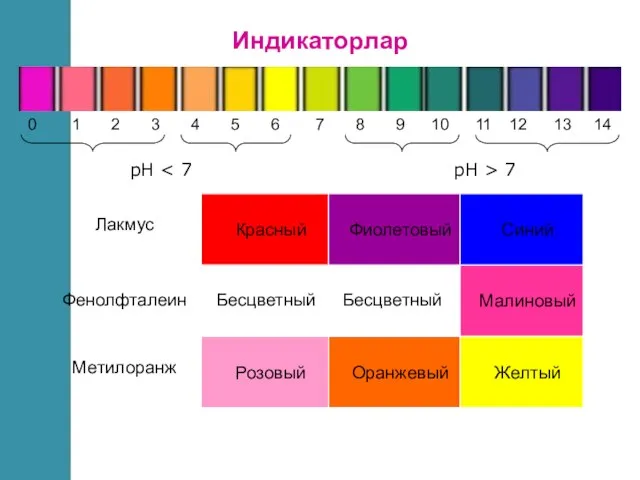
- 9. рН рН > 7 Малиновый Бесцветный Фенолфталеин Лакмус Красный Фиолетовый Синий Метилоранж Розовый Оранжевый Желтый Индикаторлар
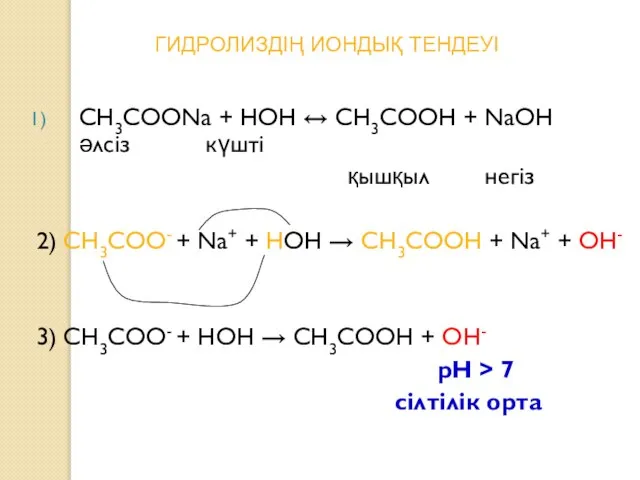
- 10. CH3COONa + HOH ↔ CH3COOН + NaOH әлсіз күшті қышқыл негіз 2) CH3COO- + Na+ +
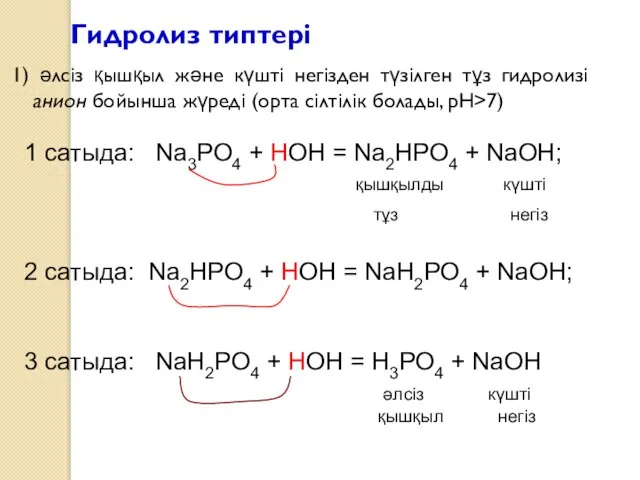
- 11. Гидролиз типтері 1) әлсіз қышқыл және күшті негізден түзілген тұз гидролизі анион бойынша жүреді (орта сілтілік
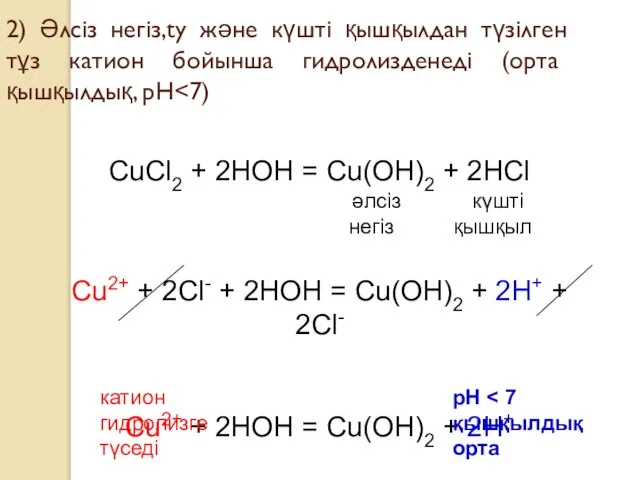
- 12. 2) Әлсіз негіз,ty және күшті қышқылдан түзілген тұз катион бойынша гидролизденеді (орта қышқылдық, рН CuCl2 +
- 13. 3) Әлсіз негізбен әлсіз қышқылдан түзілген тұз катион және анион бойынша гидролизденеді (орта бейтарап болады, рН
- 14. Күшті қышқыл ерітіндісінің рН анықтау [Н+]=Сқышқыл
- 15. Әлсіз қышқыл ерітіндісінің рН анықтау
- 16. Күшті негіз ерітіндісінің рН анықтау [ОН-] =Снегіз рОН = -lg [ОН-]
- 18. Скачать презентацию


![КН2О = [Н+][ОН-] = = 1,8⋅10-16 ⋅ 55,56 = 10-14 [Н+]*[ОН-] =10-14 Сонда таза суда:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/873558/slide-3.jpg)

![Сутектік көрсеткіш рН = - lg [Н+] рН – сутектік көрсеткіш рОН](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/873558/slide-5.jpg)


![Күшті қышқыл ерітіндісінің рН анықтау [Н+]=Сқышқыл](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/873558/slide-13.jpg)

![Күшті негіз ерітіндісінің рН анықтау [ОН-] =Снегіз рОН = -lg [ОН-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/873558/slide-15.jpg)
 Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Аммиак. Азот
Аммиак. Азот Влияние спиртов на организм человека
Влияние спиртов на организм человека Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Оксиды. Классификация
Оксиды. Классификация Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс
Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс  VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Презентация на тему Угольная кислота и её соли (9 класс)
Презентация на тему Угольная кислота и её соли (9 класс)  Химическая картина мира
Химическая картина мира углеводы (1)
углеводы (1) Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация по Химии "Классификация реакций в неорганической химии"
Презентация по Химии "Классификация реакций в неорганической химии"  Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Презентация на тему Степень окисления
Презентация на тему Степень окисления  Всё о нефти. Часть 5
Всё о нефти. Часть 5 Классы неорганических соединений
Классы неорганических соединений Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7
Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7 Строение атома
Строение атома Химия и космос
Химия и космос История развития химии
История развития химии 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov Сложные неорганические вещества
Сложные неорганические вещества Физические свойства алкенов
Физические свойства алкенов Полиамидное волокно-энант
Полиамидное волокно-энант Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков)