Содержание
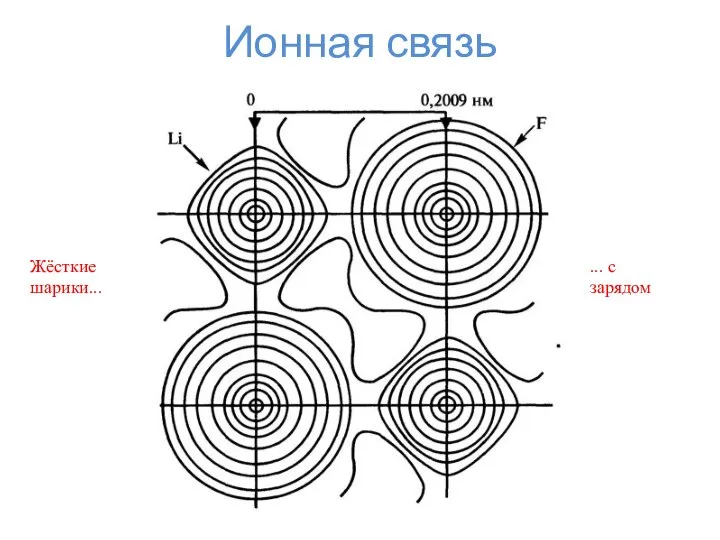
- 2. Ионная связь Жёсткие шарики... ... с зарядом
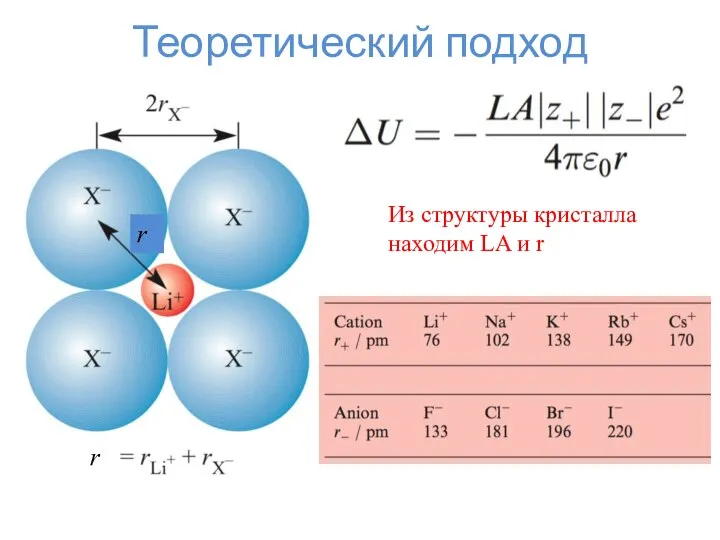
- 3. Теоретический подход r r Из структуры кристалла находим LA и r
- 4. Экспериментальный подход Цикл Борна-Габера Несоответствие ΔHрассчёт - ΔHэксперимент Что же делать???
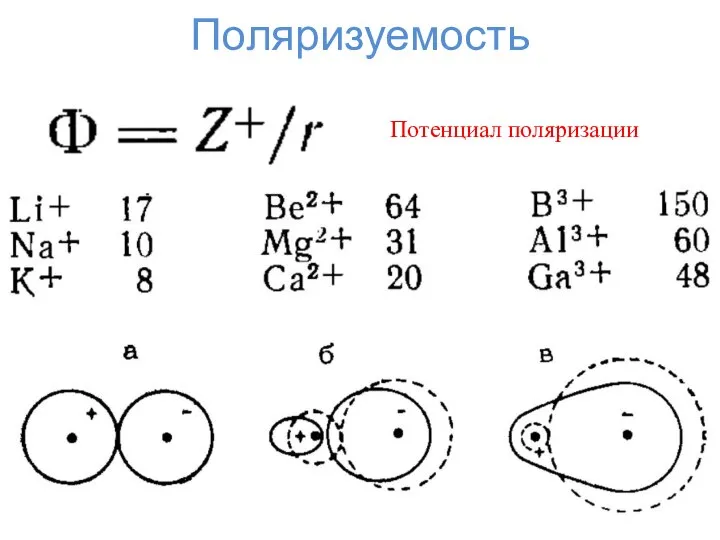
- 5. Поляризуемость Потенциал поляризации
- 6. Правила Фаянса Поляризующая способность катиона характеризуется величиной его потенциала поляризации (чем меньше и беднее катион, тем
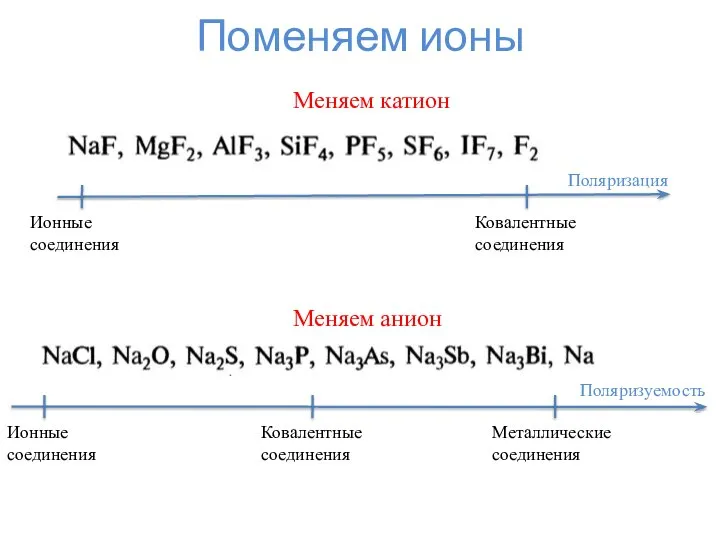
- 7. Поменяем ионы Поляризация Ковалентные соединения Ионные соединения Меняем катион Поляризуемость Металлические соединения Ионные соединения Ковалентные соединения
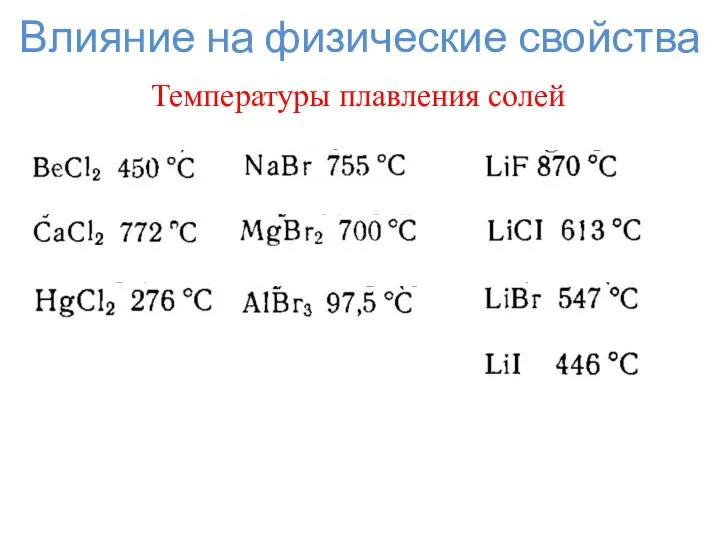
- 8. Влияние на физические свойства Температуры плавления солей
- 9. Влияние на химические свойства Температуры разложения карбонатов
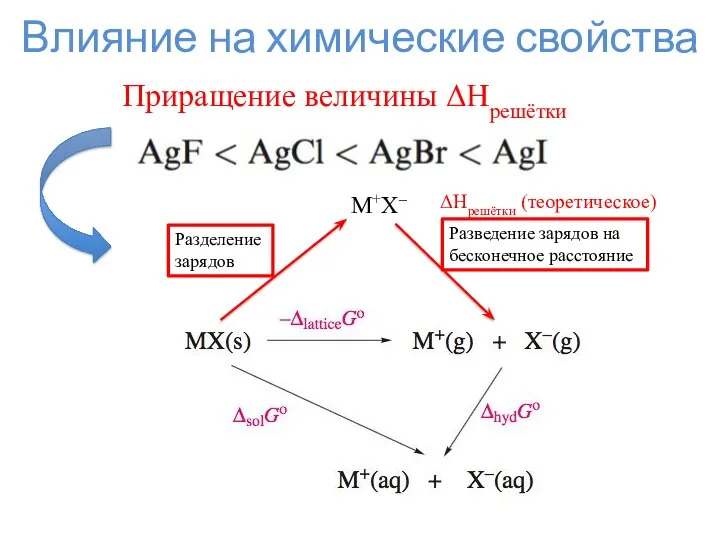
- 10. Влияние на химические свойства Приращение величины ΔHрешётки Разделение зарядов M+X– Разведение зарядов на бесконечное расстояние ΔHрешётки
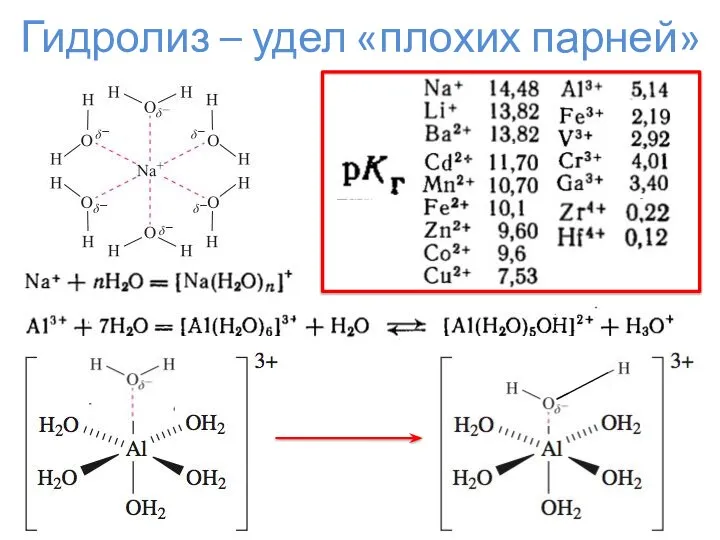
- 11. Гидролиз – удел «плохих парней»
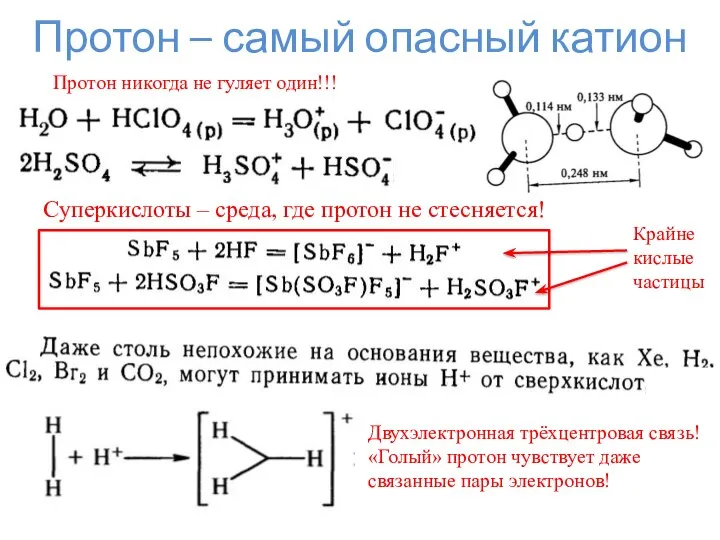
- 12. Протон – самый опасный катион Протон никогда не гуляет один!!! Суперкислоты – среда, где протон не
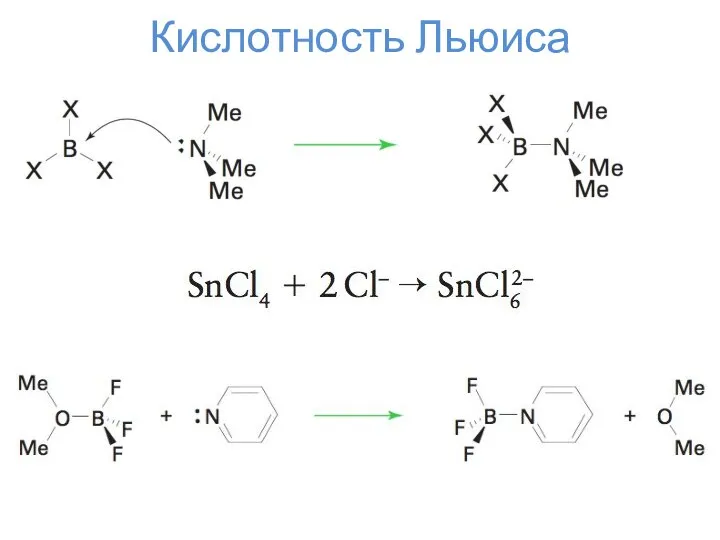
- 13. Кислотность Льюиса
- 14. Амфотерность повсюду!
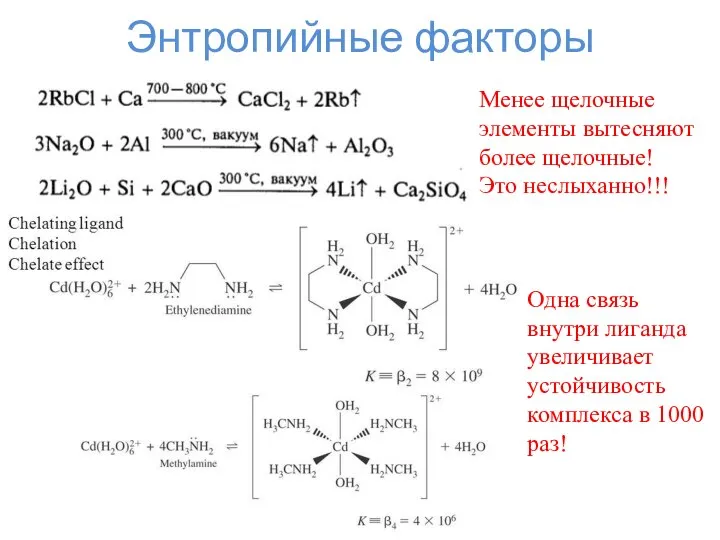
- 15. Энтропийные факторы Менее щелочные элементы вытесняют более щелочные! Это неслыханно!!! Одна связь внутри лиганда увеличивает устойчивость
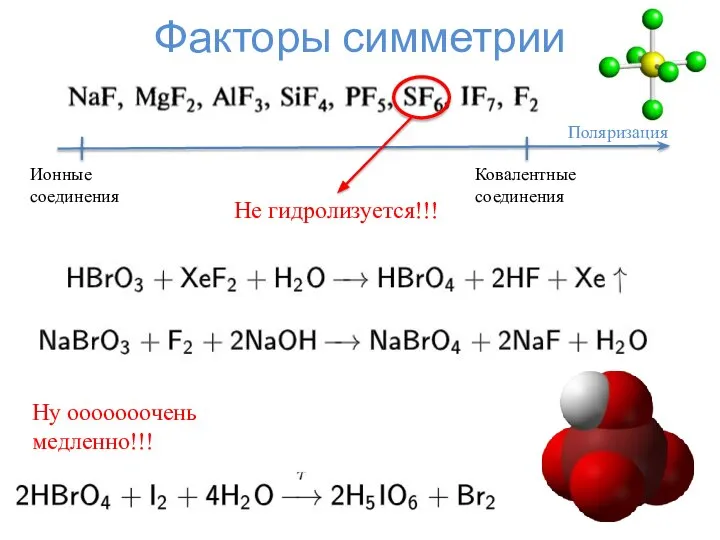
- 16. Факторы симметрии Поляризация Ковалентные соединения Ионные соединения Не гидролизуется!!! Ну ооооооочень медленно!!!
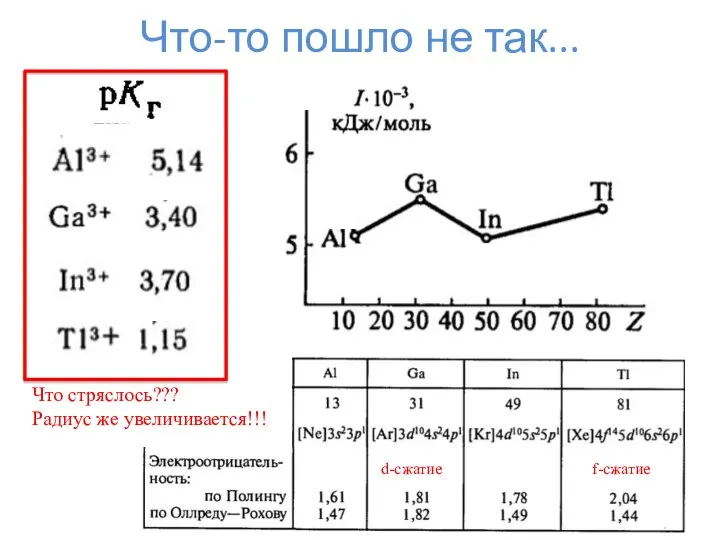
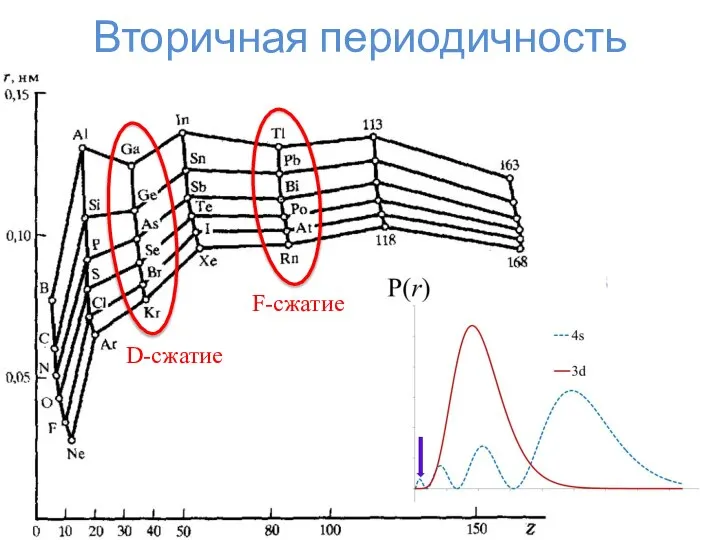
- 17. Что-то пошло не так... Что стряслось??? Радиус же увеличивается!!! d-сжатие f-сжатие
- 18. Вторичная периодичность D-сжатие F-сжатие
- 20. Скачать презентацию




 Синтез (+)-aplykurodinone-1
Синтез (+)-aplykurodinone-1 Общие физические и химические свойства металлов. 9 класс
Общие физические и химические свойства металлов. 9 класс Химическая кибернетика
Химическая кибернетика Сера
Сера Презентация на тему Химия и стирка
Презентация на тему Химия и стирка  Долговечность пластмасс
Долговечность пластмасс Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ" 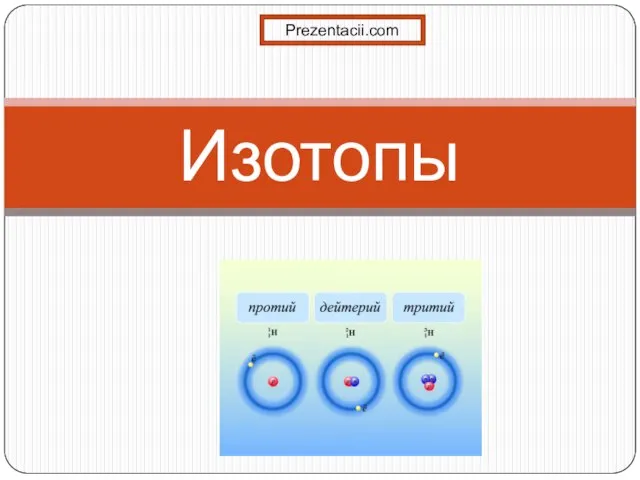 Презентация на тему Изотопы
Презентация на тему Изотопы  Презентация на тему Классификация кислот
Презентация на тему Классификация кислот  Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Полимеры. Виды полимеров
Полимеры. Виды полимеров Подача питательной воды в парогенератор при запроектной аварии
Подача питательной воды в парогенератор при запроектной аварии Алкадиены. Строение. Гомологический ряд. Изомерия. Номенклатура
Алкадиены. Строение. Гомологический ряд. Изомерия. Номенклатура Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Понятие о спиртах
Понятие о спиртах Карбоновые кислоты
Карбоновые кислоты Презентация по Химии "Алканолы"
Презентация по Химии "Алканолы"  Карбонаты. Кальцит. Малахит
Карбонаты. Кальцит. Малахит Ионная химическая связь
Ионная химическая связь Лекция 1
Лекция 1 Кремень – камень
Кремень – камень Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов