Содержание
- 2. Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет
- 3. «Третий лишний». Задание: Решите анаграммы и исключите лишнее. леруогд иксолодр ддрооов золеже углерод кислород водород железо
- 4. Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями: Порядковый номер, номер периода ,
- 5. Задание Закончите электронно - буквенную формулу и нарисуйте графическую формулу строения атома железа: Железо(№ 131835)
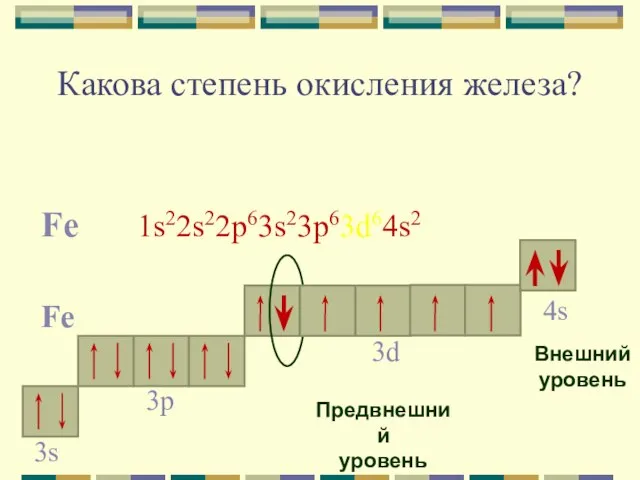
- 6. Какова степень окисления железа? Fe 1s22s22p63s23p63d64s2 Fe 4s Внешний уровень 3d Предвнешний уровень 3p 3s
- 7. Для железа характерны две основные степени окисления: +2, +3. Fe0 - 2e- = Fe+2 Fe0 -
- 8. Задание: Рассмотрите образец металла (№ 131836). Опишите физические свойства металла (№ 131797).. Используя текст учебник, заполните
- 9. Выберите и запишите цифры только тех свойств, которые не относятся к физическим свойствам железа: Серебристо-белый металл
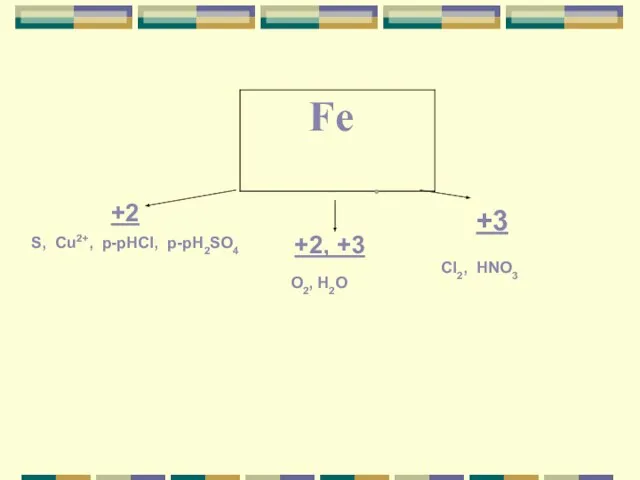
- 10. +2 +2, +3 +3 S, Cu2+, p-рHCI, p-рH2SO4 O2, H2O CI2, HNO3
- 11. Химические свойства железа Взаимодействие железа с хлором Видеофрагмент (№ 54490): 2Fe + 3Cl2 = 2FeCl3
- 12. Химические свойства железа Взаимодействие железа сВзаимодействие железа с Взаимодействие железа с кислородом: Видеофрагмент (№ 131824) Fe
- 13. : Какие из реакций соответствуют схеме Fe+2 → Fe+3 FeCI2 + CI2 = FeCI3 FeCI3 +
- 14. Задание: Расставить коэффициенты в уравнениях 1 и 3 методом электронного баланса, определить окислитель и восстановитель в
- 15. Нахождение в природе В земной коре 5,1% железа, 4 место после кислорода, кремния и алюминия. По
- 16. Нахождение в природе Метеоритное железо(№ 131727) Запишите не менее 4 -х формул соединений железа, встречающихся в
- 17. Природные соединения железа Fe FeS Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3*3H2O Лимонит (бурый железняк)
- 18. Генетические связи Fe - ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА (- ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА (II-
- 19. ПРИМЕНЕНИЕ(№ 207382) Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления трансформаторов, электромоторов
- 20. Домашнее задание § 14, с. 76 -78 № 5 с. 82 - всем № 6 с.
- 21. Используемая литература: 1. Горковенко М. Ю. Химия. 9 класс. Поурочные разработки к учебнику О. С. Габриеляна
- 23. Скачать презентацию

















 Что такое эксперимент?
Что такое эксперимент? Щелочные металлы
Щелочные металлы Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества Полезные ископаемые
Полезные ископаемые Презентация на тему Полимеры
Презентация на тему Полимеры  Растительные жиры. Пальмовое масло
Растительные жиры. Пальмовое масло Aspergillus promising biological properties
Aspergillus promising biological properties Сложные эфиры. Жиры
Сложные эфиры. Жиры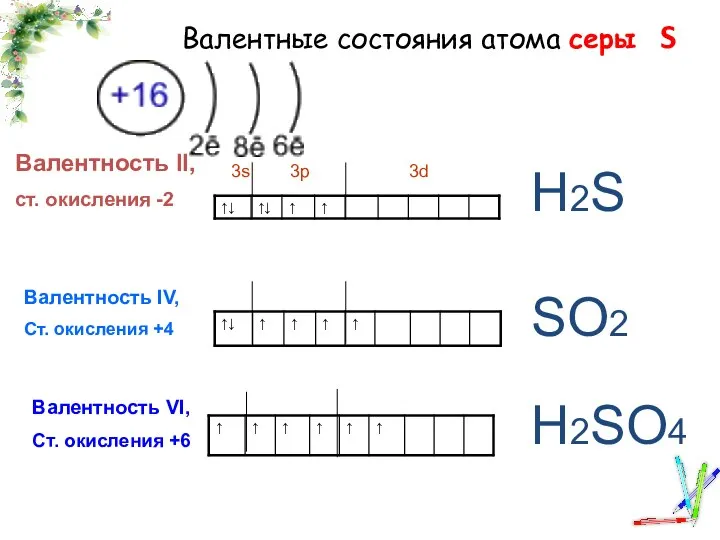 Валентные состояния атома серы
Валентные состояния атома серы относительная атомная масса
относительная атомная масса Типы химических реакций
Типы химических реакций Химическое равновесие
Химическое равновесие Предмет органической химии. Урок №1
Предмет органической химии. Урок №1 In aqua veritas. Правда в воде. Задача 12
In aqua veritas. Правда в воде. Задача 12 Витамины. Классификация витаминов
Витамины. Классификация витаминов Натуральный каучук
Натуральный каучук Вводный урок по химии
Вводный урок по химии Направление процесса. ОВР
Направление процесса. ОВР Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Микроэмульсия. Микроэмульсияның макроэмулсиядан айырмашылығы
Микроэмульсия. Микроэмульсияның макроэмулсиядан айырмашылығы Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Выращивание кристаллов соли и сахара в домашних условиях
Выращивание кристаллов соли и сахара в домашних условиях Щелочноземельные металлы
Щелочноземельные металлы Массовая доля химического элемента
Массовая доля химического элемента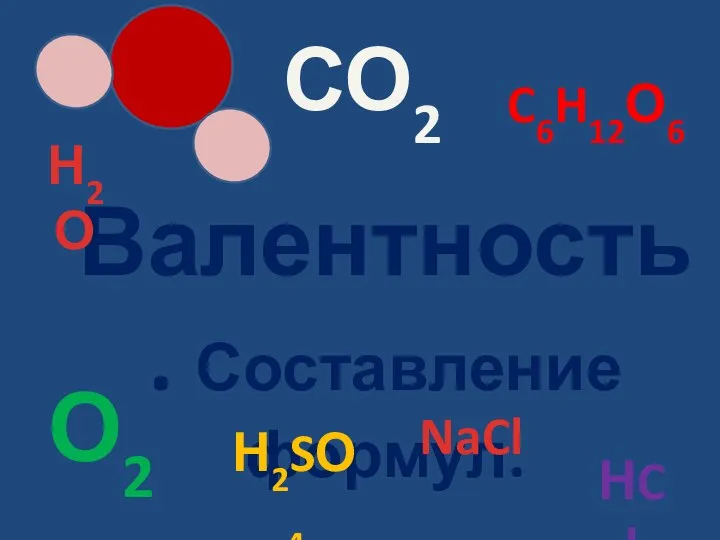 Валентность, Составление формул
Валентность, Составление формул