Содержание
- 2. «Ни одна наука не нуждается в эксперименте в такой степени, как химия. Её основные законы, теории
- 3. «Свои способности, человек может узнать только попытавшись приложить их.» Сенека Младший
- 4. Аристотель считал воду одним из «элементов» мироздания. Российский геохимик, академик Александр Евгеньевич Ферсман назвал воду самым
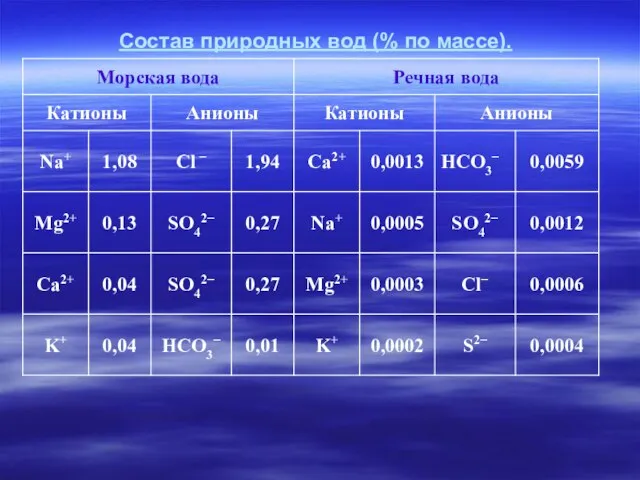
- 5. Состав природных вод (% по массе).
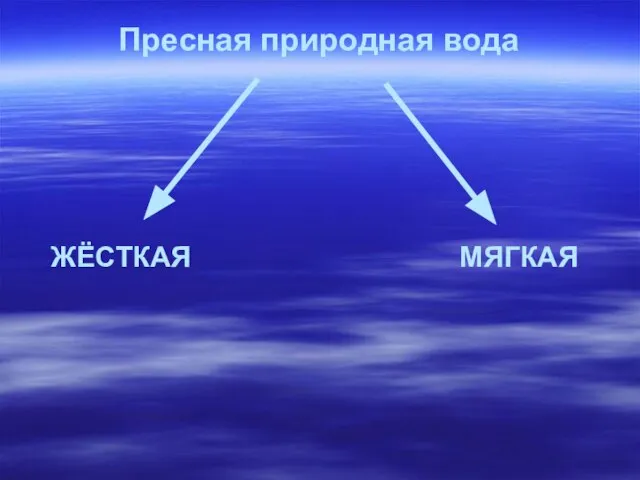
- 6. Пресная природная вода ЖЁСТКАЯ МЯГКАЯ
- 7. Жёсткая вода непригодна: Для питания паровых котлов Для применения в химической технологии В производстве керамике, бетонных
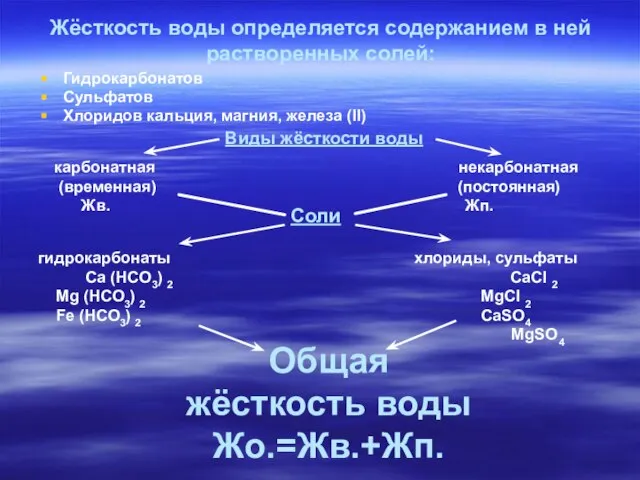
- 8. Жёсткость воды определяется содержанием в ней растворенных солей: Гидрокарбонатов Сульфатов Хлоридов кальция, магния, железа (II) Виды
- 9. Методы определения жёсткости воды Карбонатная жёсткость (временная) [Жв.] – метод кислотно-основного титрования Общая жёсткость [Жо.] –
- 10. Ваши опыты были успешны и не причинили вред вашему здоровью – ПОМНИТЕ: Совет 1: Работай строго
- 11. Следственный эксперимент Экспертные группы Химический анализ I гр. Водопроводная вода II гр. Родниковая вода III гр.
- 12. Инструкция по проведению следственного эксперимента №1 Определение жесткости водопроводной воды №2 Определение жесткости родниковой воды №3
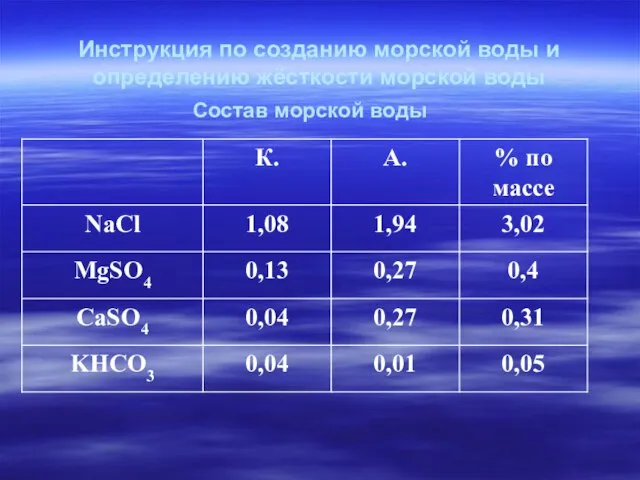
- 13. Инструкция по созданию морской воды и определению жёсткости морской воды Состав морской воды
- 14. Определение жёсткости морской воды Рассчитать весовые части солей морской воды 3,02: 0,4: 0,31: 0,05 60,4: 8
- 15. Определение жёсткости воды Примечание: Количество (ммоль) израсходованное на титрование соляной кислоты равно количеству (ммоль) солей, обуславливающих
- 16. Вычисления: Карбонатная жёсткость: Жк. =C(HCl)*V(HCl)*1000 V (H2O) V (H2O) – объём воды, взятый на титрование 1000
- 17. Инструкция по проведению химического анализа Влияние жёсткости воды на МС Цель: выяснить действия различной воды на
- 18. Информация к размышлению: Жёсткость воды влияет на пенообразование МС (мыла, стирального порошка). Оценить это качество воды
- 19. Ход работы Оборудование: Штатив с одинаковыми пробирками, стеклянные палочки, ложки, линейка, резинки аптечные, часы песочные 1мин.
- 20. Порядок действий Пронумерованные пробирки заполните на 1/5 их объёма исследуемой водой. Добавьте в каждую пробирку: а)
- 21. Жесткость воды и моющие средства
- 22. Примечание: чтобы мыло было удобно резать на равные части, его следует размягчить: кусочек мыла следует обернуть
- 23. Химическая экспертиза (в хим. лабораториях) Установлено: Iгр. Водопроводная вода Жводы = IIгр. Родниковая вода Жводы =
- 24. Общая жёсткость воды Определяется Жо. воды – методом комплексонометрии - титриметрический метод, основан на реакциях взаимодействия
- 25. Порядок действий Исследуемую воду объём 10 мл поместить в колбу. Анализируемую воду подщелочить до pH=10, прибавляя
- 26. Общая жёсткость воды (Метод комплексонометрии) – титриметрический метод, основан на реакциях взаимодействия определяемых ионов с некоторыми
- 27. Ход работы Цель: определить Жо. воды водопроводной Оборудование: бюретка, колба, химический стакан Реактивы: вода водопроводная, аммонийная
- 28. Отчёт
- 29. Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O) Где Cn (Na [H2Tr]) – нормальность трилона Б V (H2O) – объём
- 31. Скачать презентацию




![Методы определения жёсткости воды Карбонатная жёсткость (временная) [Жв.] – метод кислотно-основного титрования](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291163/slide-8.jpg)


















![Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O) Где Cn (Na [H2Tr]) – нормальность трилона Б](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291163/slide-28.jpg)
 Основы строения и свойства материалов
Основы строения и свойства материалов ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии Химический опыт Черный сахар
Химический опыт Черный сахар Степень окисления
Степень окисления Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Подгруппа алюминия
Подгруппа алюминия Алкены. Строение. Изомерия. Химические свойства. Получение
Алкены. Строение. Изомерия. Химические свойства. Получение Презентация на тему Эфиры, жиры
Презентация на тему Эфиры, жиры  Природные источники углеводородов
Природные источники углеводородов Вуглеводи. Визначення вуглеводів
Вуглеводи. Визначення вуглеводів Primenenie_kauchukov
Primenenie_kauchukov Неметаллы
Неметаллы Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Презентация на тему Полимеры. Каучуки. Резина
Презентация на тему Полимеры. Каучуки. Резина  Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Углеводы. Глюкоза
Углеводы. Глюкоза Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Презентация по Химии "Подгруппа кислорода"
Презентация по Химии "Подгруппа кислорода"  Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Оловянная чума
Оловянная чума Непредельные углеводороды ряда этиленовых
Непредельные углеводороды ряда этиленовых Тесты по химии (вопросы)
Тесты по химии (вопросы) Роль химии в Великой Отечественной войне
Роль химии в Великой Отечественной войне Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Физические свойства алкенов
Физические свойства алкенов