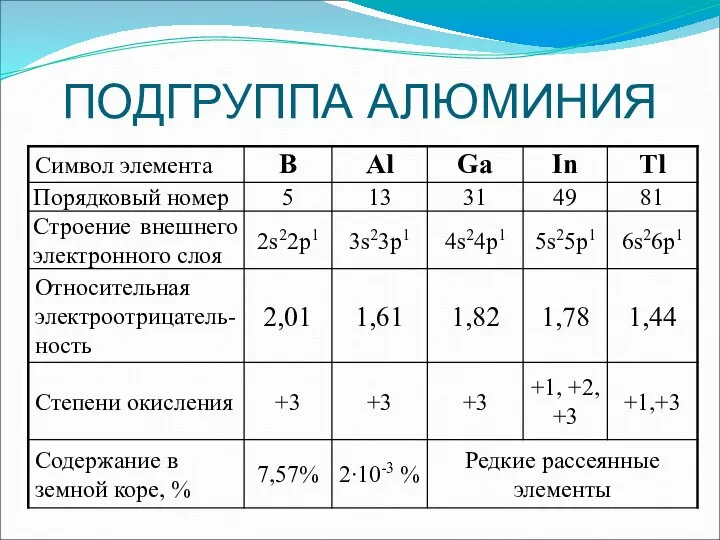
Слайд 4ПОДГРУППА АЛЮМИНИЯ
Физические свойства
1. С увеличением атомной массы усиливается металлический характер элементов (В

– неметалл; остальные – металлы).
2. Бор значительно отличается по свойствам от других элементов (высокие т.пл., т.кип., твердость; инертность).
Остальные элементы – легкоплавкие металлы, In и Tl – очень мягкие.
Слайд 5ПОДГРУППА АЛЮМИНИЯ
Химические свойства
1. Все элементы трехвалентны, но с повышением атомной массы приобретает

значение валентность, равная единице (Tl в основном одновалентен).
2. Основность гидроксидов R(OH)3 возрастает с увеличением атомной массы:
H3BO3 – слабая кислота,
Al(OH)3 и Ga(OH)3 - амфотерные гидроксиды,
In(OH)3 и Tl(OH)3 – типичные основания,
TlOH - сильное основание.
Слайд 6ПОДГРУППА АЛЮМИНИЯ
3. Металлы подгруппы алюминия (Al, Ga, In, Tl) химически достаточно активны

(реагируют с кислотами, щелочами (Al, Ga), галогенами).
4. Соли элементов подгруппы алюминия в большинстве случаев подвергаются гидролизу по катиону. Устойчивы лишь соли одновалентного таллия.
5. Al и Ga защищены тонкой оксидной пленкой; Tl разрушается при действии влажного воздуха (хранят в керосине).
Слайд 7БОР
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром

нагреванием борного ангидрида B2O3 с металлическим калием.
Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق ) или персидского бурах (перс. بوره ) которые использовались для обозначения буры:
Na2B4O7·10H2O (декагидрат тетрабората натрия).
В природе встречается в виде боросиликатов (датолит CaBSiO4OH, данбурит CaB2Si2O8) или боратов (бура Na2B4O7·10H2O, ашарит MgBO2(OH)).
Слайд 10БОР
В природе бор находится в виде двух изотопов 10В (19,8%) и 11В

(80,2 %).
Простое вещество бор имеет несколько модификаций, все они построены из соединенных разным образом группировок атомов бора, представляющих собой икосаэдр B12.
Кристаллы бора серовато-черного цвета (очень чистые — бесцветны) и весьма тугоплавки. Кристаллический бор — полупроводник. По твердости бор среди простых веществ занимает второе (после алмаза) место.
Слайд 11БОР
Получение
1.Наиболее чистый бор получают пиролизом бороводородов:
В4H10 = 4B + 5H2
Такой бор

используется для производства полупроводниковых материалов и тонких химических синтезов.
2.Метод металлотермии (чаще восстановление магнием или натрием):
B2O3 + 3Mg = 3MgO + 2B
Слайд 12БОР
3. Термическое разложение паров бромида бора на раскаленной (1000—1200 °C) вольфрамовой проволоке в

присутствии водорода (метод Ван-Аркеля):
2BBr3 + 3H2 = 2B + 6HBr
Химические свойства
1. Химический бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
2B + 3F2 = 2BF3
Слайд 13БОР
2. При нагревании бор сгорает с большим выделением теплоты, образуется прочный оксид

B2O3:
4B + 3O2 = 2B2O3
3. При нагревании бор реагирует с другими галогенами с образованием галогенидов, с азотом образует нитрид бора BN, с фосфором - фосфид BP, с углеродом - карбиды различного состава: B4C, B12C3, B13C2.
Слайд 14БОР
3. С водородом бор напрямую не взаимодействует, хотя известно довольно большое число

бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов с кислотой:
Mg3B2 + 6HCl = B2H6 + 3MgCl2
4. При сильном нагревании бор проявляет восстановительные свойства:
3SiO2 + 4B = 3Si + 2B2O3
3Р2О5 + 10В = 5В2О3 + 6Р
Слайд 15БОР
5. При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей

азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора В2О3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
В2О3 + 3Н2О = 2H3BO3
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33–), а тетрабораты:
4H3BO3 + 2NaOH = Na2B4O7 + 7Н2О
Слайд 16БОР
Применение: бор находит применение в виде добавки при получении коррозионно-устойчивых и жаропрочных

сплавов. Поверхностное насыщение стальных деталей бором (борирование) повышает их механические и антикоррозийные свойства. Карбиды бора (В4С и В13С2) обладают высокой твердостью, это хорошие абразивные материалы. Ранее их широко использовали для изготовления сверл, применяемых зубными врачами (отсюда название бормашина).
Бор служит упрочняющим веществом многих композиционных материалов. Сам бор и его соединения (нитрид BN и другие ) используются как полупроводниковые материалы и диэлектрики. Газообразный BF3 используют в счетчиках тепловых нейтронов.
Слайд 17АЛЮМИНИЙ
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825г. действием амальгамы

калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. alumen — квасцы.
До развития промышленного электролитического способа получения алюминия этот металл был дороже золота. В 1889 году британцы, желая почтить богатым подарком великого русского химика Д. И. Менделеева, подарили ему аналитические весы, у которых чашки были изготовлены из золота и алюминия.
Слайд 18АЛЮМИНИЙ
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными

следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Ar протонами космических лучей с высокими энергиями.
Слайд 19АЛЮМИНИЙ
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по

распространенности среди всех элементов (после кислорода и кремния).
Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %.
Слайд 20АЛЮМИНИЙ
Нахождение в природе
Бокситы – Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3).

Нефелины – KNa3[AlSiO4]4.
Алуниты - KAl(SO4)2 • 2Al(OH)3.
Глиноземы - смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3.
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O.
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Хризоберилл (александрит) — BeAl2O4.
Слайд 21АЛЮМИНИЙ
Корунд Al2O3
Красный корунд (примесь хрома) называют рубином, синий корунд (примесь титана и

железа) называют сапфиром.
Слайд 22АЛЮМИНИЙ
Физические свойства
Серебристо-белый металл, (ρ=2,7 г/см3), пластичный, высокая тепло- и электропроводность, t°пл.= 660°C.
Алюминий

образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Слайд 23АЛЮМИНИЙ
Получение
Современный метод получения, процесс Холла — Эру, был разработан независимо американцем Чарльзом Холлом

и французом Полем Эру в 1886г. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии и поэтому получил промышленное применение только в XX веке:
2Al2O3 →Na3AlF6 4Al + 3O2
Слайд 24АЛЮМИНИЙ
Получение
На катоде происходит восстановление ионов алюминия:
Катод: Al3+ +3e → Al0
На аноде происходит окисление алюминат-ионов:
Анод: 4AlO33- — 12e → 2Al2O3 +

3O2
Суммарное уравнение электролиза расплава оксида алюминия:
2Al2O3 → 4Al + 3O2
Слайд 25АЛЮМИНИЙ
Химические свойства
Al – покрыт тонкой и прочной оксидной пленкой (не реагирует с

H2O(t°); O2, HNO3 (без нагревания)).
Благодаря этому Al практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), Al выступает как активный металл-восстановитель. Не допустить образования оксидной плёнки можно, добавляя к алюминию такие металлы, как галлий, индий или олово.
Слайд 26АЛЮМИНИЙ
Легко реагирует с простыми веществами.
1. С кислородом:
4Al0 + 3O2 = 2Al+32O3
2. С

галогенами:
2Al0 + 3Br20 = 2Al+3Br3
3. С другими неметаллами (серой, азотом, углеродом) реагирует при нагревании:
2Al0 + 3S (t°)= Al2+3S3(сульфид алюминия)
2Al0 + N2 (t°)= 2Al+3N(нитрид алюминия)
4Al0 + 3С = Al4+3С3(карбид алюминия)
Слайд 27АЛЮМИНИЙ
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al4C3

+ 12H2O = 4Al(OH)3↓+ 3CH4↑
Со сложными веществами:
4. С водой (после удаления защитной оксидной пленки):
2Al0 + 6H2O = 2Al+3(OH)3 + 3H2↑
Слайд 28АЛЮМИНИЙ
5. Со щелочами:
2Al0 + 2NaOH + 6H2O =2Na[Al+3(OH)4] + 3H2↑
(тетрагидроксоалюминат натрия)
6. Легко
![АЛЮМИНИЙ 5. Со щелочами: 2Al0 + 2NaOH + 6H2O =2Na[Al+3(OH)4] + 3H2↑](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/969386/slide-27.jpg)
растворяется в соляной и разбавленной серной киcлотах:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2↑
При нагревании растворяется в кислотах - окислителях:
2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2↑ + 6H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O
Слайд 29АЛЮМИНИЙ
7. Восстанавливает металлы из их оксидов (алюминотермия):
8Al0 + 3Fe3O4 = 4Al2O3

+ 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
8. Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
4Al + K2Cr2O7 = 2Cr + 2KAlO2 + Al2O3
Слайд 30АЛЮМИНИЙ
2Al + 3Na2O2 = 2NaAlO2 + 2Na2O
Al + KNO3 + KOH + H2O →

K[Al(OH)4] + NH3
Al + KMnO4 + H2SO4 → Al2(SO4)3 + MnSO4 + K2SO4 + H2O
2Al + NaNO2 + NaOH + 5H2O = 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH = 3K2MnO4 + K[Al(OH)4]
Слайд 31АЛЮМИНИЙ
Применение
Еще Д.И.Менделеев писал, что «металлический алюминий, обладая большою легкостью и прочностью и

малою изменчивостью на воздухе, очень пригоден для некоторых изделий». Алюминий – один из самых распространенных и дешевых металлов. Без него трудно представить себе современную жизнь. Недаром алюминий называют металлом 20 века. Он хорошо поддается обработке: ковке, штамповке, прокату, волочению, прессованию.
Слайд 32АЛЮМИНИЙ
Применение
Чистый алюминий – довольно мягкий металл; из него делают электрические провода, детали

конструкций, фольгу для пищевых продуктов, кухонную утварь и «серебряную» краску.
Основа легких и прочных сплавов. Используется для получения ряда металлов алюминотермией.
Этот красивый и легкий металл широко используют в строительстве и авиационной технике.
Алюминий очень хорошо отражает свет. Поэтому его используют для изготовления зеркал – методом напыления металла в вакууме.
Слайд 33АЛЮМИНИЙ
В авиа- и машиностроении, при изготовлении строительных конструкций, используют значительно более твердые

сплавы алюминия. Один из самых известных – сплав алюминия с медью и магнием (дуралюмин, или просто «дюраль»; название происходит от немецкого города Дюрена). Этот сплав после закалки приобретает особую твёрдость и становится примерно в 7 раз прочнее чистого алюминия. В то же время он почти втрое легче железа. Его получают, сплавляя алюминий с небольшими добавками меди, магния, марганца, кремния и железа. Широко распространены силумины – литейные сплавы алюминия с кремнием. Производятся также высокопрочные, криогенные (устойчивые к морозам) и жаропрочные сплавы. На изделия из алюминиевых сплавов легко наносятся защитные и декоративные покрытия.
Слайд 34АЛЮМИНИЙ
В настоящее время четвертая часть всего алюминия идет на нужды строительства,

столько же потребляет транспортное машиностроение, примерно 17% часть расходуется на упаковочные материалы и консервные банки, 10% – в электротехнике.
Алюминий нашел также практическое применение в качестве ракетного топлива. Для полного сжигания 1 кг алюминия требуется почти вчетверо меньше кислорода, чем для 1 кг керосина. Кроме того, алюминий может окисляться не только свободным кислородом, но и связанным, входящим в состав воды или углекислого газа.
Слайд 35АЛЮМИНИЙ
Широкое применение находят и соединения алюминия.
Сульфат алюминия применяют для очистки воды; реагируя

с содержащимся в ней гидрокарбонатом кальция:
Al2(SO4)3 + 3Ca(HCO3)2 = 2AlO(OH) + 3CaSO4 + 6CO2 + 2H2O,
он образует хлопья оксида-гидроксида, которые, оседая, захватывают, а также сорбируют на поверхности находящиеся в воде взвешенные примеси и даже микроорганизмы.
Кроме того, сульфат алюминия применяют как протраву при крашении тканей, для дубления кожи, консервирования древесины, проклеивания бумаги.
Слайд 36ОКСИД АЛЮМИНИЯ
Al2O3
O=Al–O–Al=O
Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий).
Твердое тугоплавкое (t°пл.=2050°С) вещество;

существует в нескольких кристаллических модификациях (α – Al2O3, γ – Al2O3).
Слайд 37ОКСИД АЛЮМИНИЯ
Получение
4Al + 3O2 = 2Al2O3
2Al(OH)3 = Al2O3 + 3H2O
Амфотерный оксид с

преобладанием основных свойств; с водой не реагирует.
1. Реагирует с кислотами и растворами щелочей:
Как основной оксид:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Как кислотный оксид:
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Слайд 38ОКСИД АЛЮМИНИЯ
2. Сплавляется со щелочами или карбонатами щелочных металлов:
Al2O3 + Na2CO3 =

2NaAlO2 + CO2↑
(алюминат натрия)
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Слайд 39ГИДРОКСИД АЛЮМИНИЯ
Al(OH)3
Получение
1. Осаждением из растворов солей щелочами или гидроксидом аммония:
AlCl3 + 3NaOH

= Al(OH)3↓ + 3NaCl
Al2(SO4)3 + 6NH4OH = 2Al(OH)3↓ + 3(NH4)2SO4
Al3+ + 3OH- = Al(OH)3↓

























![АЛЮМИНИЙ 5. Со щелочами: 2Al0 + 2NaOH + 6H2O =2Na[Al+3(OH)4] + 3H2↑](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/969386/slide-27.jpg)











 Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Презентация на тему Обобщение по типам химических реакций
Презентация на тему Обобщение по типам химических реакций  Dereglarea metabolismului
Dereglarea metabolismului Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Действие активированного угля
Действие активированного угля Метод валентных связей
Метод валентных связей Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Галогены
Галогены Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Агрегатные состояния веществ: твёрдое, жидкое, газообразное
Агрегатные состояния веществ: твёрдое, жидкое, газообразное 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 8-9-10 химические формулы
8-9-10 химические формулы Кислоты и их свойства
Кислоты и их свойства Сложные эфиры. Жиры
Сложные эфиры. Жиры Презентация на тему ОВР в органической химии 11 класс
Презентация на тему ОВР в органической химии 11 класс  Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Периодическая система
Периодическая система Салқындатқыш агенттер
Салқындатқыш агенттер Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Горные породы
Горные породы Стереоизомерия
Стереоизомерия Многоатомные спирты
Многоатомные спирты