Содержание
- 2. Реакции, протекающие с изменением степени окисления называются окислительно-восстановительными.
- 3. Окислитель и восстановитель Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. Восстановителем называют реагент,
- 4. ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением
- 5. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 6. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 7. Определение степени окисления химических элементов в формуле вещества. Правила: 1. Отрицательная степень окисления = 8 -
- 8. Определение степеней окисления атомов химических элементов С.о. атомов х/э в составе простого вущества = 0 Алгебраическая
- 9. Необходимо запомнить! В соединениях с ионной связью степени окисления элементов равны зарядам ионов. Na+1Cl-1, Ca+2F2-1, Mg+2O-2.
- 10. Элементы с постоянной степенью окисления Щелочные металлы ( I группа, главная подгруппа) +1 Li, Na, K,
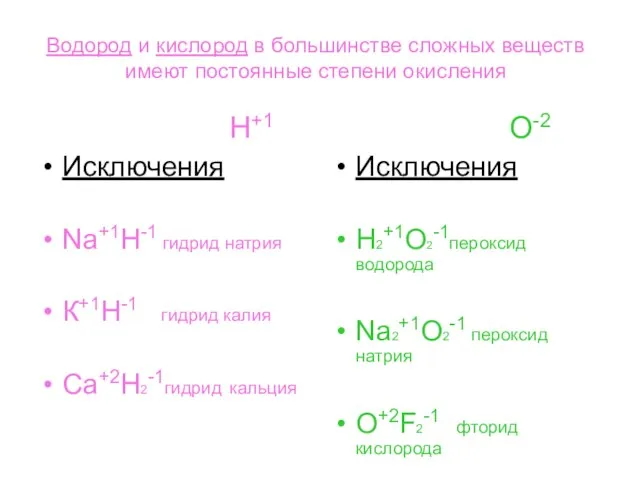
- 11. Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления Н+1 О-2 Исключения Na+1H-1 гидрид
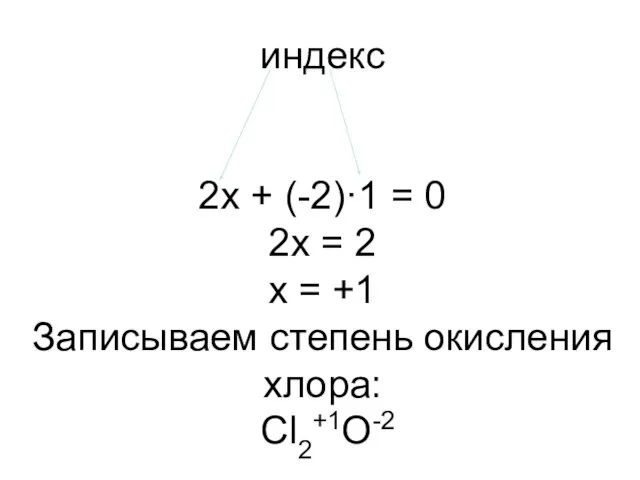
- 12. Порядок определения значений с.о. элементов: 1.Выпишем с. о. кислорода и обозначим неизвестную степень окисления хлора через
- 13. индекс 2х + (-2)·1 = 0 2х = 2 х = +1 Записываем степень окисления хлора:
- 15. Скачать презентацию










 Вода. Физические и химические свойства
Вода. Физические и химические свойства Кислоты. Классификация кислот
Кислоты. Классификация кислот Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода
Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Презентация на тему Соли аммония
Презентация на тему Соли аммония  Химические уравнения. 8 класс
Химические уравнения. 8 класс Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Каучук
Каучук Многоатомные спирты
Многоатомные спирты Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Медь и её сплавы
Медь и её сплавы Карбоксилденген этоксилаттар
Карбоксилденген этоксилаттар Bool-doser team
Bool-doser team Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Фторсодержащие полимеры
Фторсодержащие полимеры Dense Yttria Film Deposited on a Plasma-Sprayed Al2Oз Coating by Aerosol Deposition
Dense Yttria Film Deposited on a Plasma-Sprayed Al2Oз Coating by Aerosol Deposition Химические равновесия в растворах. Лекция 2 часть 2
Химические равновесия в растворах. Лекция 2 часть 2 Общая характеристика VIIА-группы – Галогены
Общая характеристика VIIА-группы – Галогены Классификация оганических соединений. 10 класс
Классификация оганических соединений. 10 класс Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Углеводы
Углеводы Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Производство азотных удобрений
Производство азотных удобрений