Содержание
- 2. I. Предмет и задачи электрохимии. Теория растворов электролитов ОВР Электролиты Теория электролитической диссоциации Сольватация Ион-дипольные взаимодействия
- 3. Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы,
- 4. Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц
- 5. Главная особенность ОВР – конкуренция за электроны между окислителем и восстановителем. В любой ОВР всегда принимают
- 6. Окислительно-восстановительных реакций: Межмолекулярные окислительно-восстановительные реакции. Внутримолекулярные окислительно- восстановительные реакции. Диспропорционирование.
- 7. 1-й закон Фарадея устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества:
- 8. 2-й закон Фарадея устанавливает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и его
- 9. Наиболее обширной группой реакций, в которых не происходит перехода электронов между атомами являются реакции ионного обмена
- 10. Электролитическая диссоциация Согласно теории электролитической диссоциации С. Аррениуса: 1. При растворении в воде (или расплавлении) электролиты
- 11. Диссоциация характеризуется также степенью диссоциации α . Степень диссоциации – отношение числа диссоциированных молекул к общему
- 12. Электролитическая диссоциация – обратимый процесс. Константы диссоциации или константы ионизации вещества: Для сильных электролитов, полностью распадающихся
- 13. Электростатические взаимодействия Кулоновские взаимодействия между ионами; Ион-дипольные, Диполь-дипольные взаимодействия с участием полярных молекул; Ван-дер-ваальсовы взаимодействия между
- 14. Сольватационными называют эффекты, возникающие в результате взаимодействия молекул растворителя с частицами растворенного вещества. электростатическая (физическая, или
- 15. II. НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ. III. ЭЛЕКТРОДНЫЕ РАВНОВЕСИЯ ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ. ОСНОВНЫЕ ПОНЯТИЯ. ЗАКОНЫ ФАРАДЕЯ. Взаимное
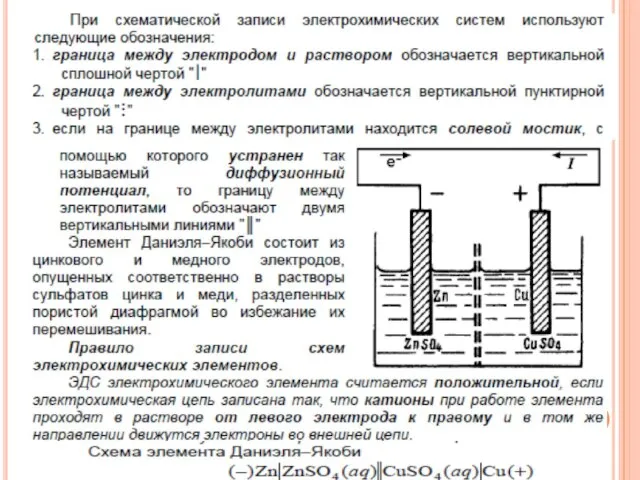
- 16. Электродом называется электрохимическая система, состоящая из веществ, обладающих различными видами проводимости и находящихся в контакте друг
- 17. В химическом источнике электрического тока — гальваническом элементе — энергия химического процесса переходит в электрическую. Различают:
- 18. Электростатические взаимодействия приводят, как уже говорилось, к отклонениям поведения системы от идеального. Метод активностей – вместо
- 19. Отношение активности частицы к ее равновесной концентрации А называют коэффициентом активности γ: Коэффициенты активности ионов в
- 20. Ионная сила I и вычисляемой по уравнению: где zi — заряд иона Ai; суммирование ведется по
- 21. В разбавленных растворах (I при I → 0 значения γi → 1. Растворы с очень низкой
- 27. Удельная электрическая проводимость раствора электролита æ — это электрическая проводимость объема раствора, заключенного между двумя параллельными
- 28. Молярная электрическая проводимость раствора электролита Λ численно равна электрической проводимости объема V (м3) раствора, заключенного между
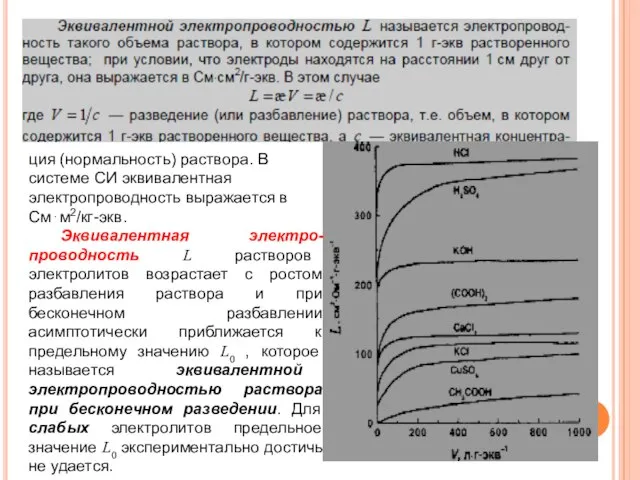
- 29. Молярная электропроводность с уменьшением концентрации увеличивается и в пределе c→0 стремится к некоторому предельному максимальному значению
- 30. α и β — температурные коэффициенты электрической проводимости. Коэффициенты α и β зависят от природы электролита:
- 31. ПОДВИЖНОСТЬ ИОНОВ. ЗАКОН КОЛЬРАУША Электрическая проводимость электролита определяется скоростью движения ионов. Пусть электрический ток проходит через
- 32. скорости движения катионов и анионов в направлении поля (м/с).
- 33. Молярная электрическая проводимость растворов электролитов зависит от: степени диссоциации электролита взаимодействия между ионами в электролите. С
- 34. ция (нормальность) раствора. В системе СИ эквивалентная электропроводность выражается в См⋅м2/кг-экв. Эквивалентная электро-проводность L растворов электролитов
- 36. В растворе электролита ионы движутся беспорядочно. При наложении на раствор электрического поля беспорядочное движение ионов в
- 37. Перемещение ионов H3O+ и OH− происходит по так называемому эстафетному механизму передачи протона вдоль цепочки молекул
- 43. Чем выше химический потенциал μi i -го сорта частиц в данной фазе, тем сильнее тенденция к
- 44. Гальвани-потенциалом называется разность внутренних потенциалов g2−g1 соседних фаз. Поскольку гальвани-потенциалы невозможно экспериментально измерить (любое подключение измерительных
- 45. В настоящее время в качестве эталонного электрода используют стандартный водородный электрод (платиновая нить, погруженная в электролит,
- 46. Рассмотрим простейшую ситуацию: условие равновесия между металлом и его ионами в растворе: где O — окисленная
- 47. ψ=gO−gR — равновесный электродный потенциал, равный разности потенциалов между точками внутри металла и раствора (гальвани-потенциал), μO
- 51. ЭЛЕКТРОДЫ ПЕРВОГО РОДА
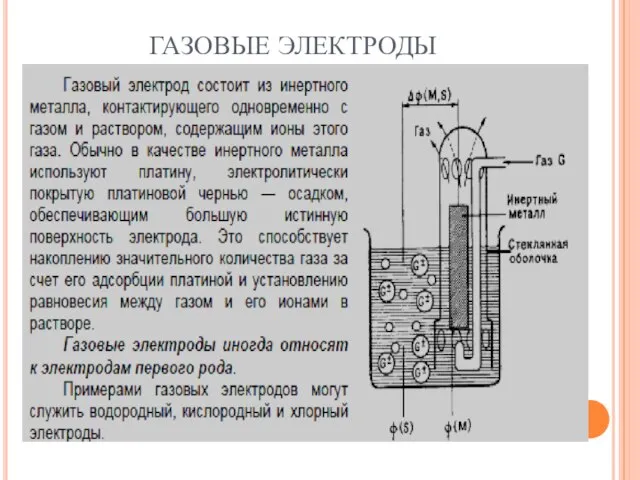
- 52. ГАЗОВЫЕ ЭЛЕКТРОДЫ
- 53. АМАЛЬГАМНЫЕ ЭЛЕКТРОДЫ
- 54. ЭЛЕКТРОДЫ ВТОРОГО РОДА
- 55. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ЭЛЕКТРОДЫ
- 56. ХИМИЧЕСКИЕ ЦЕПИ В зависимости от природы и свойств электродов из которых составлена электрохимическая система, различают химические
- 57. Потенциометрия
- 60. Скачать презентацию






















































 История открытия водорода. Получение и физические свойства водорода
История открытия водорода. Получение и физические свойства водорода Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Применение коллоидных систем
Применение коллоидных систем ОГЭ химия. Основной государственный экзамен
ОГЭ химия. Основной государственный экзамен Каучук
Каучук Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Сера и ее соединения
Сера и ее соединения Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Индолы. Cтроение индола
Индолы. Cтроение индола Кислоты в химии
Кислоты в химии Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения Стехиометрические законы химии
Стехиометрические законы химии Общая характеристика неметаллов
Общая характеристика неметаллов Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Спирты
Спирты Ароматические углеводороды. Строение молекулы бензола. Физические свойства
Ароматические углеводороды. Строение молекулы бензола. Физические свойства Полиуретановые полимеры
Полиуретановые полимеры Валентность
Валентность Дизельное топливо
Дизельное топливо Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год
Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год Электрохимические процессы
Электрохимические процессы Азотсодержащие соединения. (Лекция 13)
Азотсодержащие соединения. (Лекция 13) Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Получение серной кислоты
Получение серной кислоты Електролітична дисоціація
Електролітична дисоціація Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура