Содержание
- 6. сапфир рубин
- 7. Проверочная самостоятельная работа Задание: составьте формулы бинарных соединений по степеням окисления: Вариант I Вариант II 1.
- 8. Правильные ответы Вариант 1 Вариант 2 1. Fe+2 Br2-1 1. Cu+2Cl2-1 2. Ba+2H2-1 2. Na 3+1
- 9. Выделите незнакомые вам соединения: P2O5, FeBr2, CuCl2, H3N, CaО, SO3, BaH2, Al2O3 , Na 3 P,
- 10. Какими общими признаками обладают соединения? Предложите алгоритм составления формул указанных веществ. Поясните правила их номенклатуры. P2O5,
- 11. ОКСИДЫ - сложные вещества, состоят из 2-х химических элементов (бинарные), один из элементов - кислород в
- 12. ОКСИДЫ
- 13. Цель работы: уточнить определение сложных веществ оксидов и узнать алгоритм составления формул оксидов и правила их
- 14. Гипотеза: если знать алгоритм составления формул и правила номенклатуры веществ, можно правильно отразить состав и названия
- 15. План работы: Сформулировать определение оксидов (работа с текстом учебника – стр. 107). Уточнить правила составления формул
- 16. 1. Оксиды - сложные вещества, состоящие из 2-х химических элементов, один из которых кислород в степени
- 17. Какими общими признаками обладают соединения? Предложите алгоритм составления формул указанных веществ. Поясните правила их номенклатуры. P2O5,
- 18. Выполните тесты 1.Общая формула оксидов: А) Эx Оy Б) Эх Ну В) Эх Ну О. 2.
- 19. Выполните тесты 4. Установите соответствие между формулой оксида и названием Формула оксида Название оксида 1.NO А)
- 20. Проверим: 1.Общая формула оксидов: А) Эx Оy Б) Эх Ну В) Эх Ну О. 2. Ряд
- 21. Проверим 4. Установите соответствие между формулой оксида и названием Формула оксида Название оксида 1.NO А) оксид
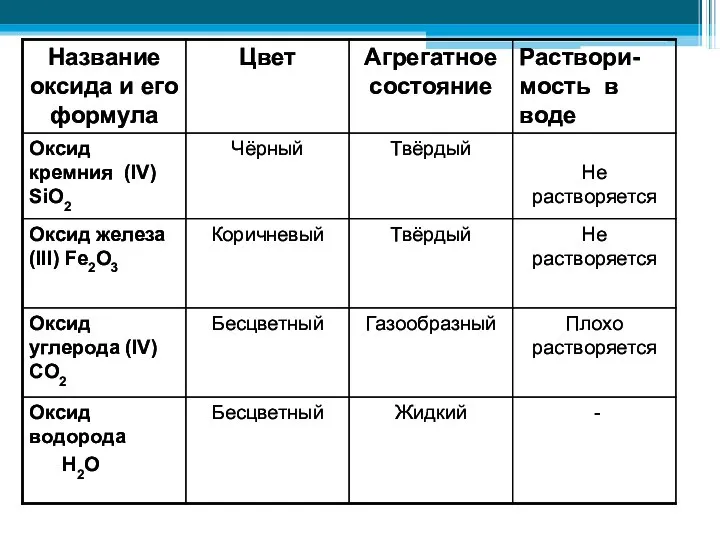
- 22. Лабораторный опыт «Знакомство с образцами оксидов» Исследовать физические свойства некоторых оксидов и области их распространения в
- 24. Выводы по лабораторной работе: Оксиды обладают разными физическими свойствами: цветом, растворимостью в воде, агрегатным состоянием при
- 25. Вода
- 26. Что такое вода? Минерал не имеющий цвета, Не имеющий запаха, формы, но ты оглянись – Это
- 32. Газ, необходимый растениям для фотосинтеза Содержание углекислого газа в атмосфере всего 0,04—0,03%. В воздухе, выдыхаемом человеком,
- 33. Сухой лед – тоже CO2 Сухой лед в отличие от водяного льда плотный. Он тонет в
- 34. В земной коре оксиды часто встречаются в виде минералов
- 35. Красные и магнитные железняки Бурый железняк
- 36. Оксид кремния (IV) SiO2 Плиний считал, что горный хрусталь «рождается из небесной влаги и чистейшего снега».
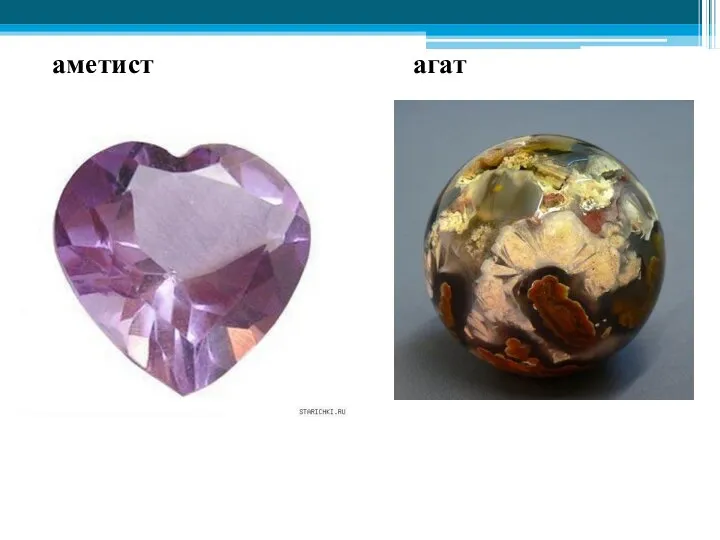
- 38. аметист агат
- 39. сапфир рубин
- 40. Проверим В земной коре – литосфере – находится оксид алюминия Al2O3(глина), оксид кремния (IV) SiO2(песок), оксид
- 42. Скачать презентацию





































 Слабые и сильные электролиты
Слабые и сильные электролиты Пименов_Химический состав
Пименов_Химический состав Выращивание кристаллов соли и сахара в домашних условиях
Выращивание кристаллов соли и сахара в домашних условиях Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Презентация на тему: Подгруппа азота
Презентация на тему: Подгруппа азота Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Основания. Формулы двух амфотерных оксидов
Основания. Формулы двух амфотерных оксидов Применение центрифугирования
Применение центрифугирования Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Основные сведения о строении атома
Основные сведения о строении атома Предмет органической химии
Предмет органической химии Искусственные и синтетические полимеры
Искусственные и синтетические полимеры Полімери
Полімери Реакции поликонденсации
Реакции поликонденсации Состав популярных напитков, рН-группа
Состав популярных напитков, рН-группа Химические процессы на кухне (урок №7)
Химические процессы на кухне (урок №7) Альдегиды и кетоны
Альдегиды и кетоны Центрифугирование в гидробиологии
Центрифугирование в гидробиологии Валентность
Валентность Свойства неорганических веществ
Свойства неорганических веществ Гидролиз солей
Гидролиз солей Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием
Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием Металлы
Металлы Спирты
Спирты Kristālisku vielu uzbūve
Kristālisku vielu uzbūve Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода