Содержание
- 2. Цель урока Изучить: строение молекулы аммиак; водородную связь на примере аммиака и как она повлияла на
- 3. Самостоятельная работа
- 4. Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных
- 5. По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан». Так называли всех
- 6. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый-химик, академик
- 7. История открытия аммиака Аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Луи
- 8. 1723-1802 г. В 1784 французский химик Бертолле разложением аммиака доказал его элементный состав, который в 1787
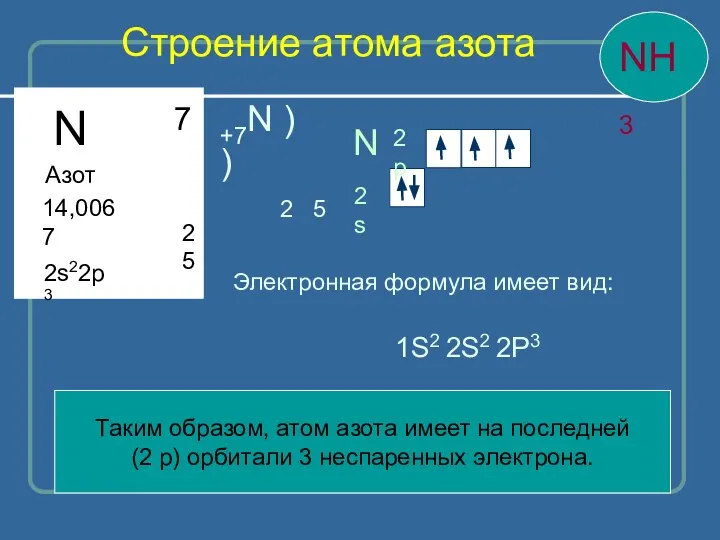
- 9. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 2s 2p Таким образом, атом
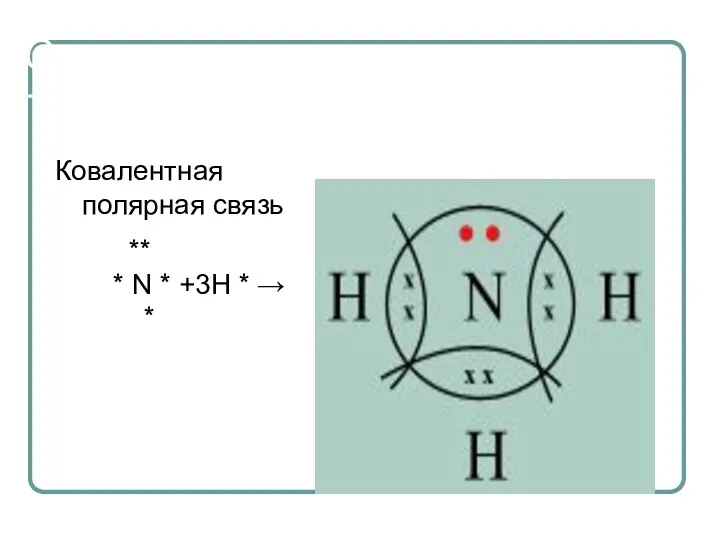
- 10. Строение молекулы аммиака Ковалентная полярная связь ** * N * +3H * → *
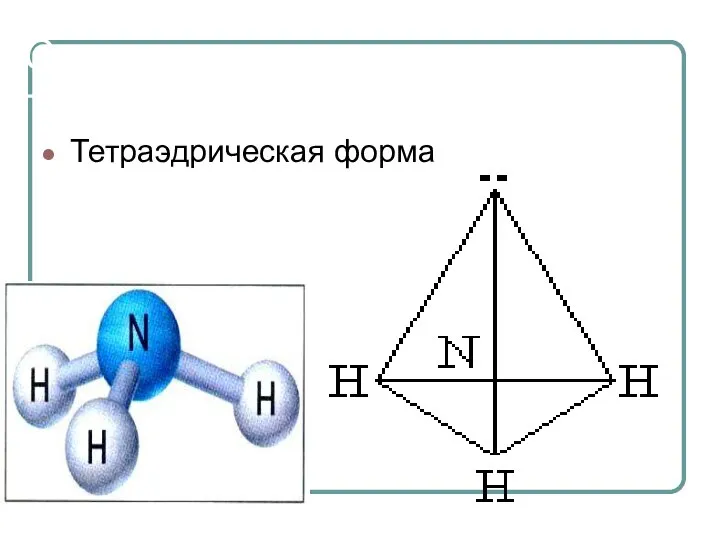
- 11. Строение молекулы аммиака Тетраэдрическая форма
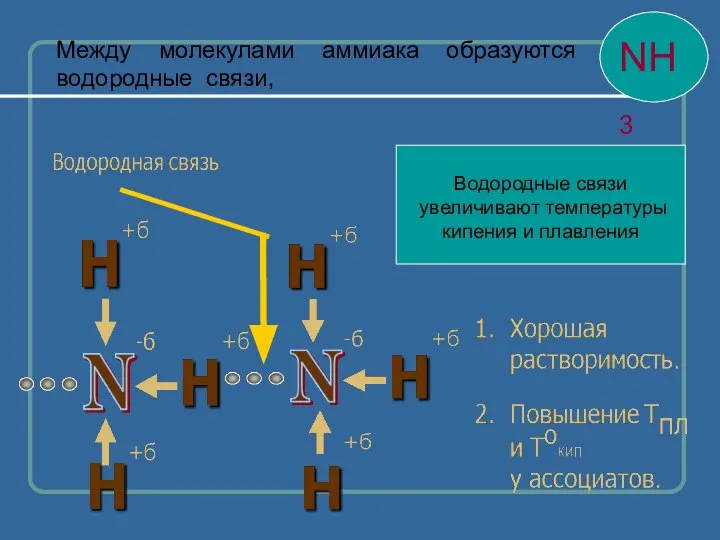
- 12. Водородные связи увеличивают температуры кипения и плавления Между молекулами аммиака образуются водородные связи,
- 13. Физические свойства -бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха в два раза; t кип.= -33,40C;
- 14. Получение 1. Промышленный способ N2 + 3Н2 → 2NH3 (p=1000 атм; t= 5000C; kat = Fe
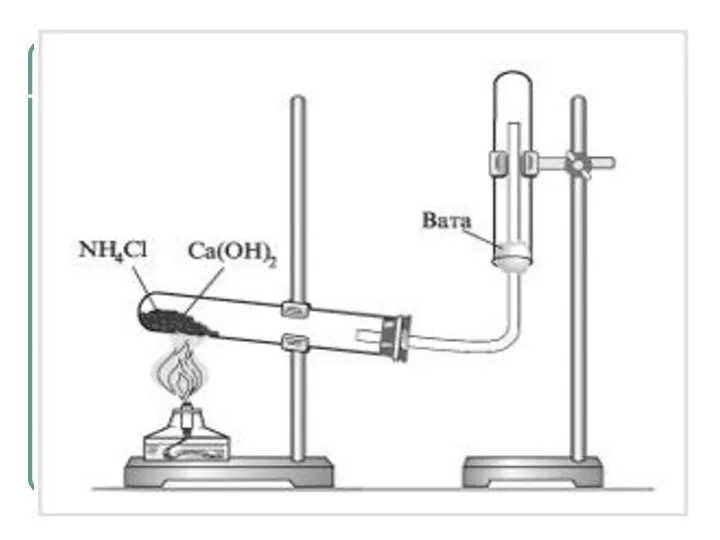
- 15. Получение Лабораторный способ. Нагревание солей аммония со щелочами. http://files.school-collection.edu.ru/dlrstore/b1a915ff-ba50-e3cc-c3bf-62f523839dd2/index.htm 2NH4Cl + Ca(OH)2→ CaCl2 + 2NH3↑+2Н2O (NH4)2SO4
- 17. Жидкий аммиак
- 18. Твердый аммиак
- 19. Химические свойства 1.Взаимодействие с водой http://files.school-collection.edu.ru/dlrstore/c739e753-ecdd-db99-7b9f-29c205abeb99/index.htm NH3 + Н2O → NH4OH (гидроксид аммония) NH4OH →NH4+ +
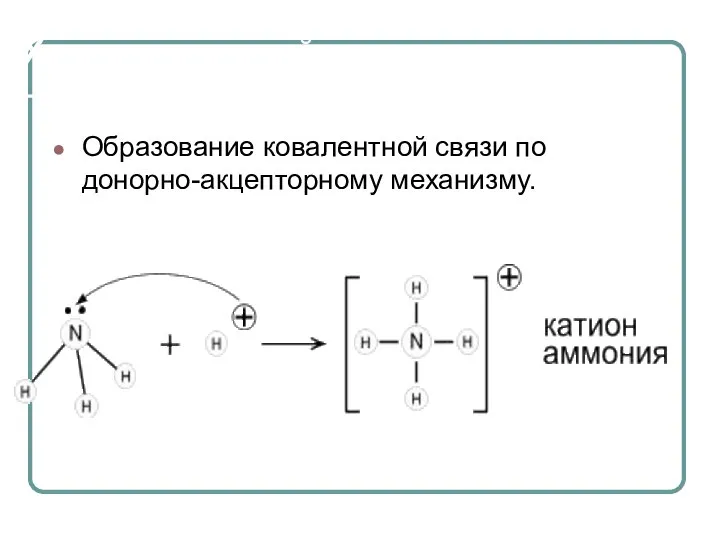
- 20. . Химические свойства Образование ковалентной связи по донорно-акцепторному механизму.
- 21. Химические свойства 2. С кислотами с образованием солей аммония. NH3 + HCl → NH4Cl (хлорид аммония,
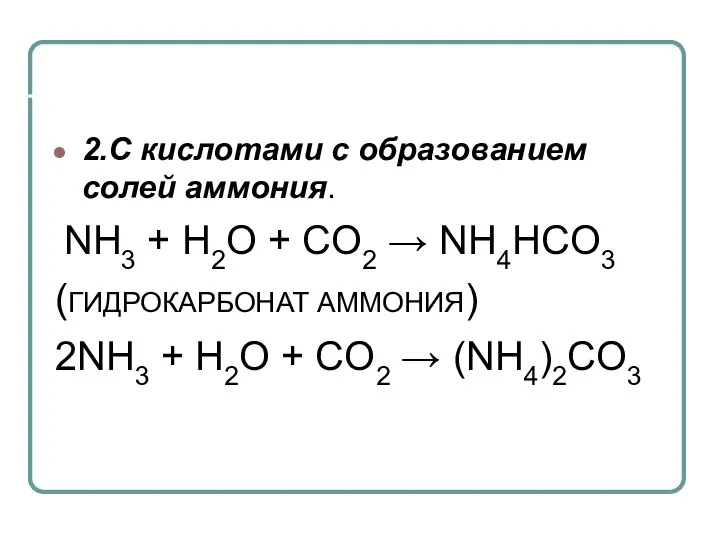
- 22. 2.С кислотами с образованием солей аммония. NH3 + H2O + CO2 → NH4HCO3 (ГИДРОКАРБОНАТ АММОНИЯ) 2NH3
- 23. Химические свойства 3.Разложение при нагревании 2NH3 → N2↑+ 3H2↑ 4.Восстановление оксидов некоторых металлов 3CuO +2NH3 →
- 24. 5. Горение в кислороде a)без катализатора 4NH3 + 3O2 →2 N2 ↑+ 6H2О http://files.school-collection.edu.ru/dlrstore/54ebbc62-eded-0811-a50f-50aa71e517cf/index.htm
- 25. б)каталитическое окисление ( kat = Pt ) 4NH3 + 5O2 →4 NО+ 6H2О
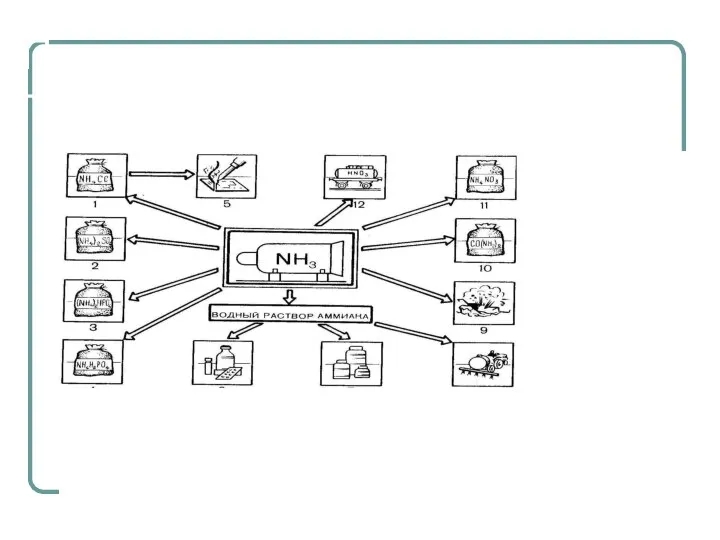
- 26. Применение
- 27. вывод Познакомились с водородной связью на примере аммиака; Изучили механизм образования иона аммония; Изучили физические и
- 29. Скачать презентацию

















 Алканы 10-класс
Алканы 10-класс Кислород и сера
Кислород и сера Клеящие материалы
Клеящие материалы Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Получение аминов
Получение аминов Тест по неметаллам
Тест по неметаллам Тест по теме: Алкины
Тест по теме: Алкины Авиационное материаловедение. Лекция №1: Введение. Теория сплавов
Авиационное материаловедение. Лекция №1: Введение. Теория сплавов Амины. Аминокислоты
Амины. Аминокислоты Карбоновые кислоты
Карбоновые кислоты Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений физические и химические явления
физические и химические явления Неорганическая химия, часть 1
Неорганическая химия, часть 1 Консультация по химии
Консультация по химии Внеклассное мероприятие по химии для учащихся 8 классов
Внеклассное мероприятие по химии для учащихся 8 классов Классификация веществ. Урок №7
Классификация веществ. Урок №7 Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Получение и химические свойства оксидов
Получение и химические свойства оксидов Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Классификации по атомному весу
Классификации по атомному весу Защитить кабель. Задача 9
Защитить кабель. Задача 9 Направление химических реакций
Направление химических реакций Алкены-1 (строение, изомерия, номенклатура)
Алкены-1 (строение, изомерия, номенклатура) Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Непредельные углеводороды
Непредельные углеводороды Вода и её свойства
Вода и её свойства Изомерия. Классификация органических веществ
Изомерия. Классификация органических веществ Понятие о веществе. Свойства веществ
Понятие о веществе. Свойства веществ