Содержание
- 2. Гелий Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода.
- 3. История открытия. 18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения
- 4. Свойства гелия. Гелий — практически инертный химический элемент. Простое вещество гелий — нетоксично, не имеет цвета,
- 5. Чаще всего люди используют гелий для надувания воздушных шариков.
- 6. Получение гелия. В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом
- 8. Скачать презентацию
Слайд 2Гелий
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе
Гелий
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе

Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой
Слайд 3История открытия.
18 августа 1868 года французский учёный Пьер Жансен, находясь во время
История открытия.
18 августа 1868 года французский учёный Пьер Жансен, находясь во время

Спустя два месяца, 20 октября, английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Спустя два года Локьер совместно с английским химиком Эдуардом Франклендом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце»).
Слайд 4Свойства гелия.
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксично, не
Свойства гелия.
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксично, не

Гелий — наименее химически активный элемент восьмой группы (инертные газы) и вообще всей таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He+2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Энергия связи молекулярного иона гелия He+2 составляет 58 ккал/моль, равновесное межъядерное расстояние — 1,09 Å.
Известно эксимерное химическое соединение гелия LiHe
Физические свойства
Химические свойства
Слайд 5Чаще всего люди используют гелий для надувания воздушных шариков.
Чаще всего люди используют гелий для надувания воздушных шариков.

Слайд 6Получение гелия.
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время
Получение гелия.
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время

Охлаждение производят дросселированием в несколько стадий, очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода.
Эту смесь, так называемый сырой гелий (70—90 % гелия по объёму) очищают от водорода (4—5 %) с помощью CuO при 650—800 К.
Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активированном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % гелия по объёму) и высокой чистоты (99,985 %).
 Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Тест по химии
Тест по химии Синтез олигомеров этиленгликоля и терефталевой кислоты
Синтез олигомеров этиленгликоля и терефталевой кислоты Простые и сложные вещества
Простые и сложные вещества Химический элемент натрий
Химический элемент натрий 596550
596550 Строение атома
Строение атома Круговорот серы в природе
Круговорот серы в природе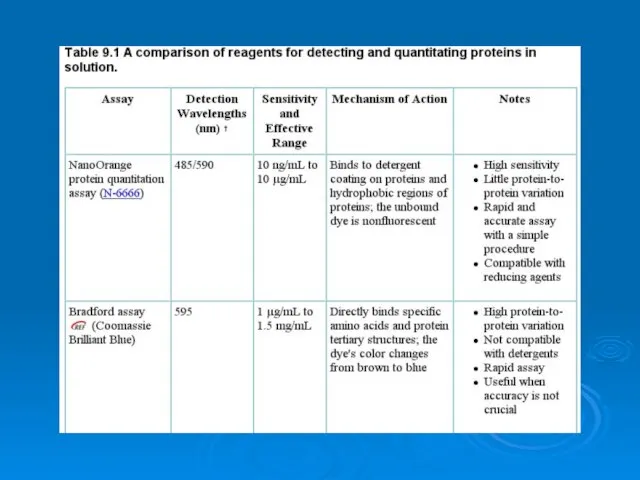 Analysis of proteins
Analysis of proteins Предельные одноатомные спирты
Предельные одноатомные спирты Металлы в организме человека
Металлы в организме человека f8ea0c69dfd043588bd2a8735e944773
f8ea0c69dfd043588bd2a8735e944773 Центробежное осаждение
Центробежное осаждение Алкины
Алкины Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Применение алкинов
Применение алкинов Перегонка. Вклад алхимиков в органическую химию
Перегонка. Вклад алхимиков в органическую химию Химия, химия, химия!
Химия, химия, химия! Алюминий
Алюминий Строение вещества
Строение вещества Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Основания. 8 класс
Основания. 8 класс Основания, их состав и название
Основания, их состав и название Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Единые смеси
Единые смеси Особенности строения электронных оболочек атомов элементов больших периодов
Особенности строения электронных оболочек атомов элементов больших периодов Ионные уравнения
Ионные уравнения