Содержание
- 2. СОЖЕРЖАНИЕ: ВВЕДЕНИЕ ЗОЛОТО СЕРЕБРО МЕДЬ ЖЕЛЕЗО РТУТЬ ОЛОВО СВИНЕЦ
- 3. ОЛИМПИАДОР - ГРЕЧЕСКИЙ ФИЛАСОВ И АСТРОЛОГ, ПРОФЕССОР АЛЕКСАНДРИЙСКОЙ ШКОЛЫ. ИМЕННО ОН СООТНЕС ПЛАНЕТЫ И МЕТАЛЛЫ СОЛНЦЕ-ЗОЛОТО,
- 4. ЗОЛОТО Золото (лат.Aurum) Золото-элемент редкий, его содержание в земной коре составляет всего 4,310-7%. В природе золото
- 5. СЕРЕБРО Серебро (лат. Argentum) Серебро – драгоценный металл, известный с глубокой древности. Серебренные самородки люди находили
- 6. МЕДЬ Медь (лат. Cuprum) Медь входит более чем в 170 минералов, из которых для промышленности важны
- 7. ЖЕЛЕЗО Железо (лат.Ferrum) Железо можно назвать главным металлом нашего времени. Это химический элемент очень хорошо изучен.
- 8. РТУТЬ Ртуть- элемент редкий и рассеянный, его содержание примерно 4,5*10\6% от массы земной коры. Тем не
- 9. ОЛОВО Олово- один из металлов, известных людям с древности. Это средний по распространенности элемент, в природе
- 10. СВИНЕЦ Свинец (лат. Plumbum) Свинец – это синевато-серый мягкий и тяжелый металл, это цветной металл. Самородный
- 12. Скачать презентацию
Слайд 3ОЛИМПИАДОР - ГРЕЧЕСКИЙ ФИЛАСОВ И АСТРОЛОГ, ПРОФЕССОР АЛЕКСАНДРИЙСКОЙ ШКОЛЫ.
ИМЕННО ОН СООТНЕС ПЛАНЕТЫ
ОЛИМПИАДОР - ГРЕЧЕСКИЙ ФИЛАСОВ И АСТРОЛОГ, ПРОФЕССОР АЛЕКСАНДРИЙСКОЙ ШКОЛЫ. ИМЕННО ОН СООТНЕС ПЛАНЕТЫ

\\
Слайд 4ЗОЛОТО
Золото (лат.Aurum) Золото-элемент редкий, его содержание в земной коре составляет всего 4,310-7%.
ЗОЛОТО
Золото (лат.Aurum) Золото-элемент редкий, его содержание в земной коре составляет всего 4,310-7%.

Золото добывают и попутно- при переработке полиметаллических и медных руд. Есть оно и в морской воде – в крайне малых концентрациях.
В представлении алхимиков золото считалось «царем металлов». Причиной тому, очевидно, его эффектный внешний вид, неизменный блеск и устойчивость к действию подавляющего большинства реагентов. Золото при нагревании не реагирует с кислородом, водородом, углеродом, азотом, щелочами и большинством кислот. Растворяется золото лишь в хлорной воде, смеси соляной и азотной кислот (царской водке), в растворах цианидов щелочных металлов, продуваемых воздухом, а также в ртути
В ювелирных и технических изделиях применяют не чистое золото, а его сплавы, чаще всего с медью и серебром, а его сплавы, чаще всего с медью и серебром. Чистое золото – металл слишком мягкий, ноготь оставляет на нем след, износостойкость его невысока. Проба, стоящая на золотых изделиях отечественного производства, означает содержание золота в сплаве из расчета на тысячу его весовых часте
Слайд 5СЕРЕБРО
Серебро (лат. Argentum) Серебро – драгоценный металл, известный с глубокой древности. Серебренные
СЕРЕБРО
Серебро (лат. Argentum) Серебро – драгоценный металл, известный с глубокой древности. Серебренные

Чистое серебро – блестящий белый металл, очень мягкий, по ковкости уступает лишь золоту. Лучше всех металлов проводит тепло и электрический ток.
Как и другим благородным металлам, серебру свойственна высокая химическая стойкость. Серебро не вытесняет водород из растворов обычных кислот, не изменяется на чистом и сухом воздухе, но, если в воздухе содержатся сероводород и другие летучие соединения серы, серебро темнеет. Азотная и концентрированная серная кислоты медленно реагируют с серебром, растворяя его.
Бромид серебра чрезвычайно важен для фото- и кинопромышленности как важнейший компонент светочувствительной пленки.
Поскольку мировые запасы этого металла уменьшаются, серебро стараются заменить везде, где только можно. Для этого химики-технологи ищут рецептуры бессеребренных светочувствительных кинофотоматериалов. Из похожих на серебро сплавов на никелевой основе делают монеты, посуду и художественные изделия.
Слайд 6МЕДЬ
Медь (лат. Cuprum) Медь входит более чем в 170 минералов, из которых
МЕДЬ
Медь (лат. Cuprum) Медь входит более чем в 170 минералов, из которых

Каменные глыбы пирамиды Хеопса были обработаны медным инструментом. Целый период истории человечества назван медным веком.
Чистая медь – тягучий, вязкий металл красного, в изломе разового цвета, в очень тонких слоях на просвет медь выглядит зеленовато-голубой. В соединениях медь обычно проявляет степень окисления +1 и +2, известны также немногочисленные соединения трехвалентной меди.
Медь-металл сравнительно мало активный. В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Она достаточно легко вступает в реакции с галогенами, серой, селеном. А вот с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах.
Особенно важна медь для электротехники. По электропроводности медь занимает II место среди всех металлов - после серебра. Однако в наши дни во всем мире электрические провода, на которые раньше уходила почти половина выплавляемой меди, все чаще делают из алюминия. Он хуже проводит ток, но легче и доступнее.
Чаще всего медь вносят в почву в виде пятиводного сульфата – медного купороса. В значительных количествах он ядовит. В малых дозах медь совершенно необходима всему живому.
Слайд 7
ЖЕЛЕЗО
Железо (лат.Ferrum) Железо можно назвать главным металлом нашего времени. Это химический элемент
ЖЕЛЕЗО
Железо (лат.Ferrum) Железо можно назвать главным металлом нашего времени. Это химический элемент

Первое железо, попавшее в руки человека, вероятно, неземного происхождения. Ежегодно на Землю падает больше тысячи метеоритов, часть их железные, состоящие в основном из никелистого железа. Самый большой из обнаруженных железных метеоритов весит около 60 т. Он найден в 1920 г. В юго-западной части Африки. У «небесного» железа есть одна важная технологическая особенность: в нагретом виде этот металл не поддается ковке, ковать можно лишь холодное метеоритное железо. Оружие из «небесного» металла долгие века оставалось чрезвычайно редким и драгоценным.
Железо- металл войны, но это и важнейший металл мирной техники. Из железа, как полагают ученые, состоит ядро Земли, и вообще на Земле это один из самых распространенных элементов. На Луне железо найдено в больших количествах в двухвалентном состоянии и самородное. В таком же виде железо существовало и на Земле, пока на ней восстановительная атмосфера не сменилась на окислительную, кислородную. Еще в глубокой древности было открыто замечательное явление – магнитные свойства железа, которые объясняются особенностями строения электронной оболочки атома железа. В древности железо ценилось очень высоко.
Основная масса железа находится в месторождениях, которые можно разрабатывать промышленным способом. По запасам в земной коре железо занимает 4 место среди всех элементов, после кислорода, кремния и алюминия. Намного больше железа в ядре планеты. Но это железо недоступно и вряд ли станет доступным в обозримом будущем. Больше всего железа – 72,4% - в магнетите.
Железо – блестящий серебристо-белый металл, его легко обрабатывать: резать, ковать, прокатывать, штамповать.
Слайд 8РТУТЬ
Ртуть- элемент редкий и рассеянный, его содержание примерно 4,5*10\6% от массы земной
РТУТЬ
Ртуть- элемент редкий и рассеянный, его содержание примерно 4,5*10\6% от массы земной

Ртуть- тяжелый металл, серебристо-белого цвета, единственный метал, жидкий при обычных условиях. Затвердевает ртуть при температуре -38,9С, закипает – при 357,25С. При нагревании ртуть довольно сильно расширяется, плохо проводит электрический ток и тепло- в 50 раз хуже серебра.
Как и благородные металлы, ртуть на воздухе не изменяется- не окисляется кислородом, не реагирует с другими компонентами атмосферы. С галогенами ртуть реагирует легче ,чем с кислородом; взаимодействует с азотной кислотой, а при нагревании и с серной. В соединении, ртуть всегда двухвалентна.
Соединения ртути весьма ядовиты. Работа с ними требует не меньшей осторожности, чем с самой ртутью.
В промышленности и в технике ртуть используют очень широко и разнообразно. Каждый из нас держал в руках ртутный термометр. Ртуть работает и в других приборах- барометрах, расходомерах. Важны ртутные катоды в производстве хлора и едкого натра, щелочных и щелочноземельных металлов, известны ртутные выпрямители переменного тока, ртутные лампы.
Слайд 9ОЛОВО
Олово- один из металлов, известных людям с древности. Это средний по распространенности
ОЛОВО
Олово- один из металлов, известных людям с древности. Это средний по распространенности

Олово- достаточно пластичный серебристо-белый металл, плавится при 231.9С, кипит при 2270С. Существует при двух аллотропических модификациях– альфа и бета-олово.
При комнатной тем температуре олово обычно существует в бета-форме. Это всем известное белое олово- знакомый привычный металл, из которого раньше отливали оловянных солдатиков, делали посуду и которым до сих пор покрывают изнутри консервные банки.
При температуре ниже 13,2С более устойчивей альфа-олово- серый мелкокристаллический порошок. Процесс превращения белого олова в серое быстрее всего идет при -33С. Это превращение получило образное название «оловянной чумы». В прошлом оно не раз приводило к драматическим последствиям.
Химическая стойкость олова достаточно высокая. При температуре до 100С оно практически не окисляется кислородом воздуха- лишь поверхность покрывается тонкой оксидной пленкой. Растворяет олово и азотная кислота, даже разбавленная и на холоде.
Большая часть олова идет на производство припоев и сплавов, главным образом типографических и подшипниковых.
Слайд 10СВИНЕЦ
Свинец (лат. Plumbum) Свинец – это синевато-серый мягкий и тяжелый металл, это
СВИНЕЦ
Свинец (лат. Plumbum) Свинец – это синевато-серый мягкий и тяжелый металл, это

Самородный свинец встречается крайне редко. Чаще всего свинец встречается в виде в виде сульфида. Этот хрупкий блестящий минерал серого цвета называют галенитом, или свинцовым блеском.
Плавится свинец при температуре 327,4°С, а кипит при 1725°С. Плотность его 11,34 г/см. Свинец – пластичный, мягкий металл: он режется ножом, царапается ногтем
На воздухе он быстро покрывается тонким слоем оксида. Разбавленные соляная и серная кислоты на свинец почти не действуют, но он растворяется в концентрированных серной и азотной кислотах. С середины XIV в. из свинца отливали пули для огнестрельного оружия, в XV в. Гуттенберг в Германии приготовил знаменитый типографский сплав сурьмы, свинца и олова, или гарт, и положил начало книгопечатанию.
Легкоплавкий, удобный в переработке, свинец широко применяется в наши дни. Свинец хорошо поглощает рентгеновское и радиоактивное излучение.

 Получение и применение алкадиенов
Получение и применение алкадиенов Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории
Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Вклад учёных-химиков в Великую победу
Вклад учёных-химиков в Великую победу Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Агрегатные состояния веществ
Агрегатные состояния веществ Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Химическое равновесие. Задачи
Химическое равновесие. Задачи Разбор задач
Разбор задач Алкадиены, каучуки
Алкадиены, каучуки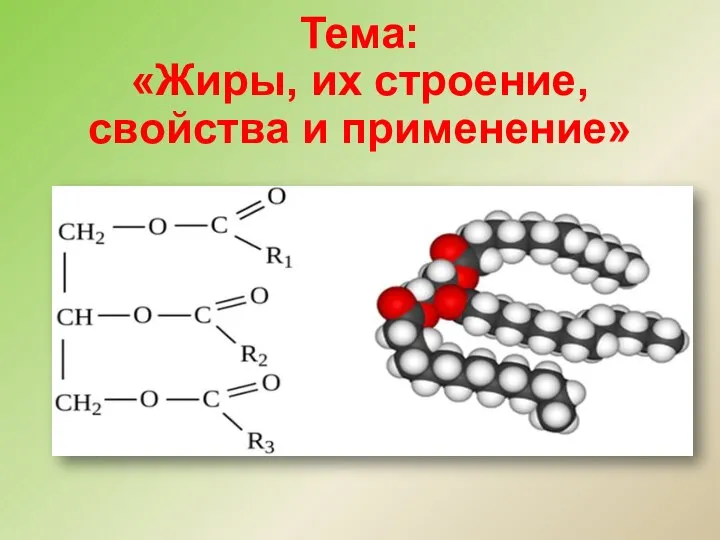 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Классификация оксидов
Классификация оксидов Щелочные металлы
Щелочные металлы Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Комплексные соединения
Комплексные соединения Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Введение в органическую химию
Введение в органическую химию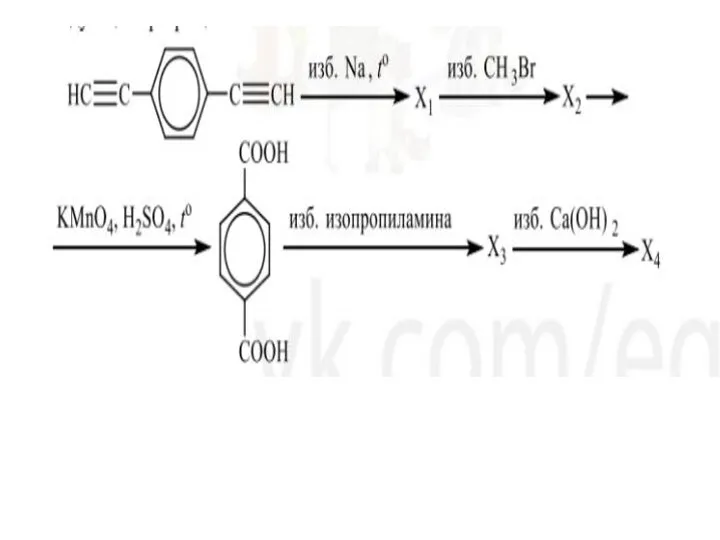 Арены
Арены Составление формул солей
Составление формул солей Молярный объем газов
Молярный объем газов