Содержание
- 2. Образование двойного электрического слоя Причины возникновения двойного электрического слоя (ДЭС): Поверхностная диссоциация ионов; Адсорбция ионов из
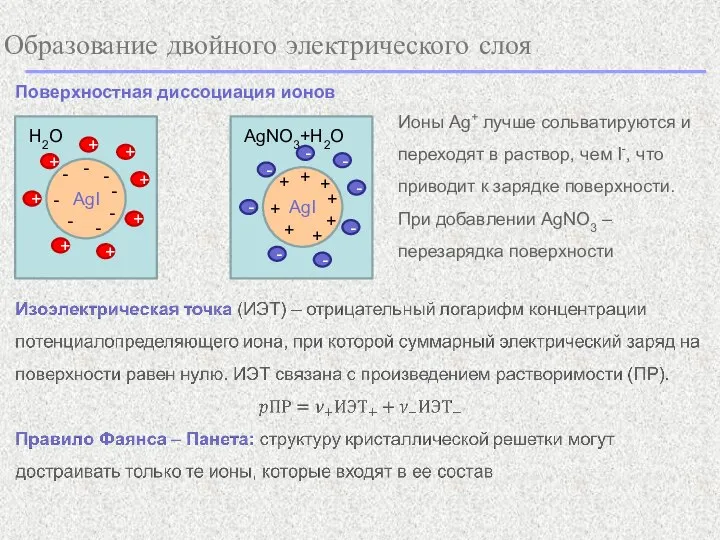
- 3. Образование двойного электрического слоя Поверхностная диссоциация ионов Ионы Ag+ лучше сольватируются и переходят в раствор, чем
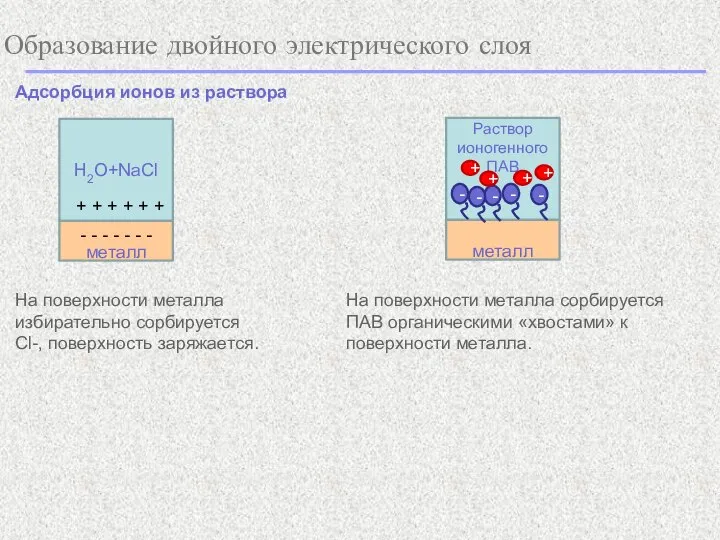
- 4. Образование двойного электрического слоя Адсорбция ионов из раствора На поверхности металла избирательно сорбируется Cl-, поверхность заряжается.
- 5. Образование двойного электрического слоя Адсорбция диполей. Контакт с неполярными жидкостями ДЭС могут образовывать и неполярные (малополярные)
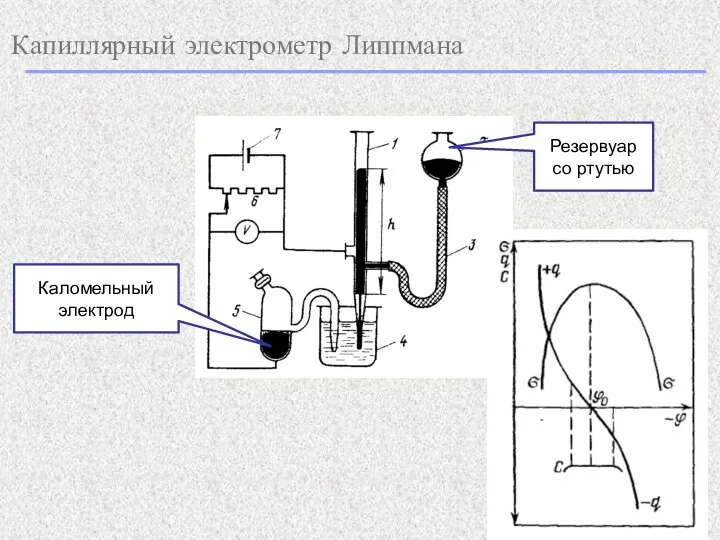
- 6. Капиллярный электрометр Липпмана Резервуар со ртутью Каломельный электрод
- 7. Первое уравнение Липпмана - первое уравнение Липпмана
- 8. Второе уравнение Липпмана. Емкость ДЭС - первое уравнение Липпмана - второе уравнение Липпмана
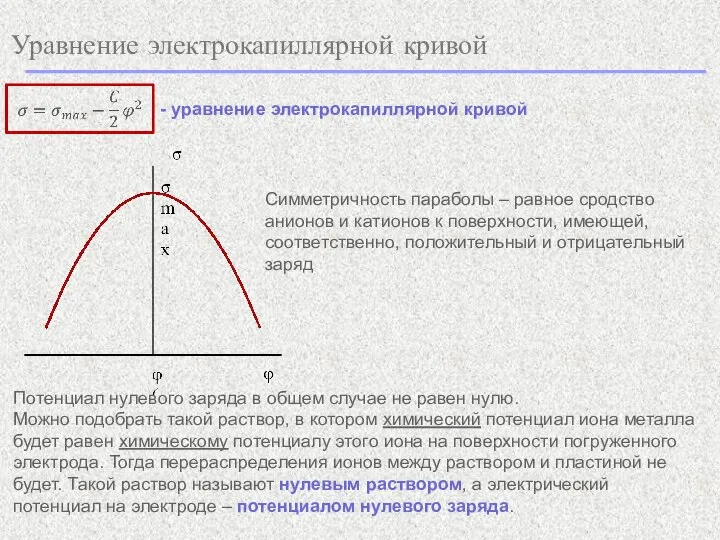
- 9. Уравнение электрокапиллярной кривой - первое уравнение Липпмана - второе уравнение Липпмана Потенциал нулевого заряда - уравнение
- 10. Уравнение электрокапиллярной кривой - уравнение электрокапиллярной кривой Симметричность параболы – равное сродство анионов и катионов к
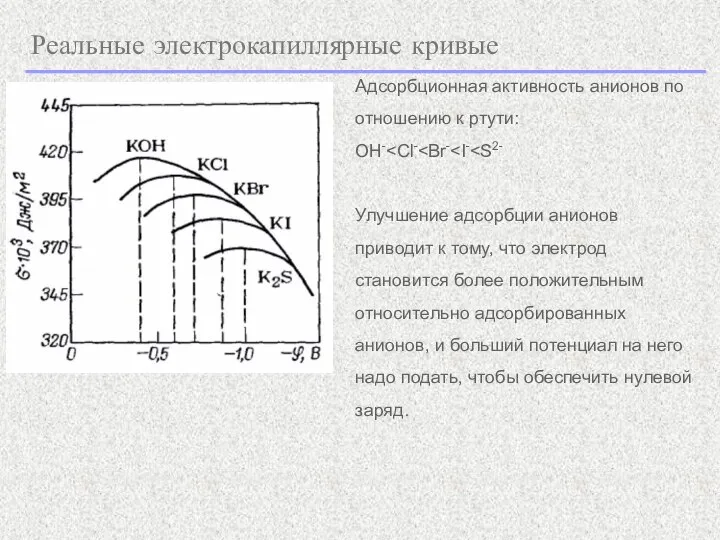
- 11. Реальные электрокапиллярные кривые Адсорбционная активность анионов по отношению к ртути: OH- Улучшение адсорбции анионов приводит к
- 12. Строение ДЭС Эволюция представлений о строении ДЭС Взгляды Гельмгольца (плоский конденсатор) Теория Гуи – Чепмена (учет
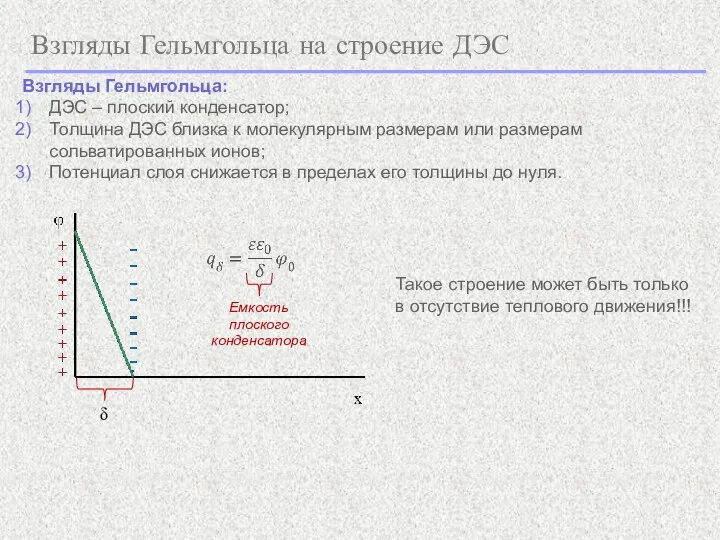
- 13. Взгляды Гельмгольца на строение ДЭС Взгляды Гельмгольца: ДЭС – плоский конденсатор; Толщина ДЭС близка к молекулярным
- 14. Теория Гуи - Чеппмена Концентрация в объеме Заряд иона Число Фарадея
- 15. Теория Гуи - Чеппмена Эл. потенциал на расстоянии x от поверхности - уравнение Пуассона - Больцмана
- 16. Теория Гуи - Чеппмена пренебрегаем Равно 0 из соображений электро-нейтральности Слабозаряж. поверхность Удвоенная ионная сила I
- 17. Теория Гуи - Чеппмена
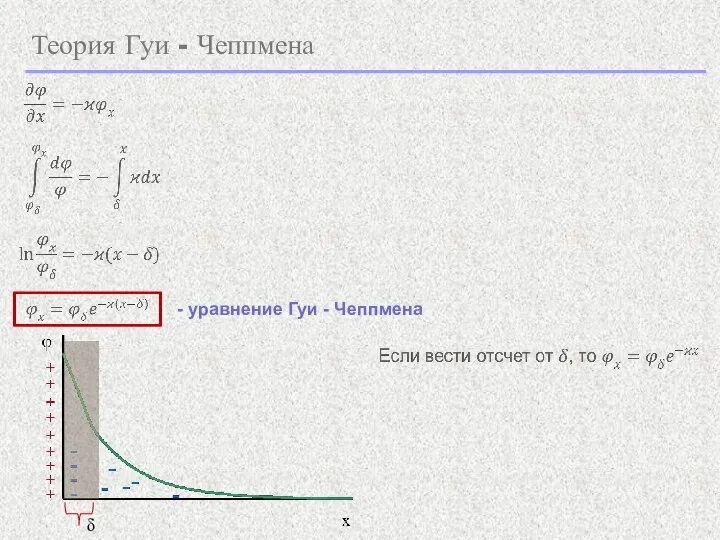
- 18. Теория Гуи - Чеппмена - уравнение Гуи - Чеппмена δ
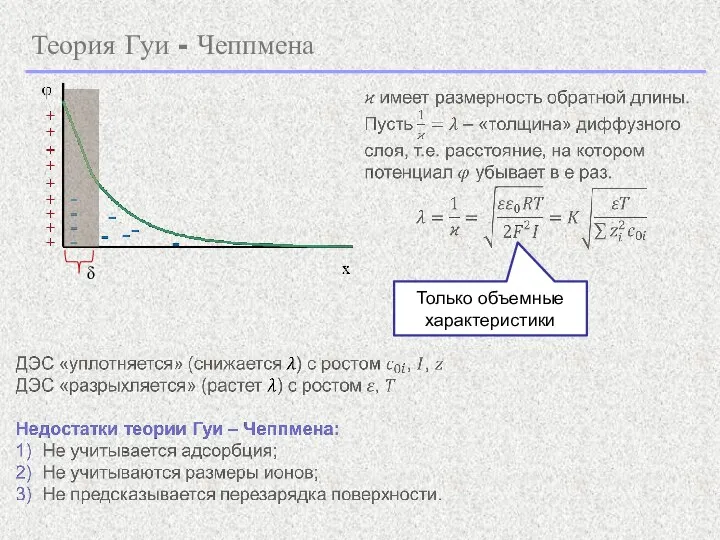
- 19. Теория Гуи - Чеппмена δ Только объемные характеристики
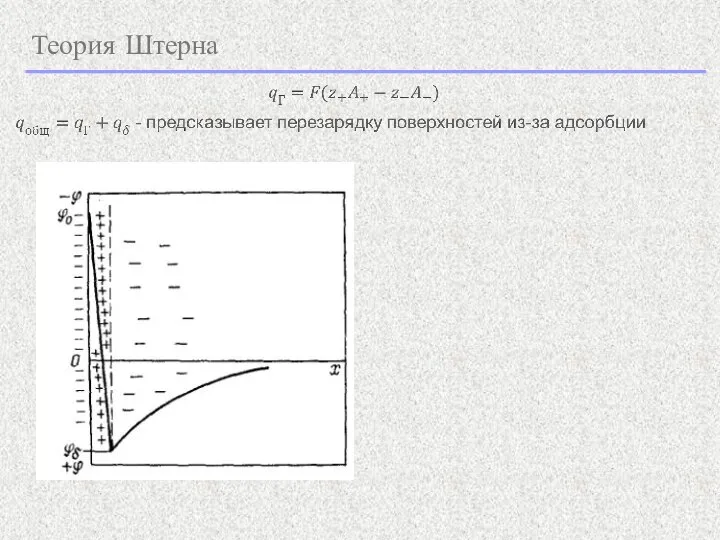
- 20. Теория Штерна δ Слой Гельмгольца Диффузный слой
- 21. Теория Штерна
- 22. Теория Штерна Учет знака заряда иона
- 23. Теория Штерна
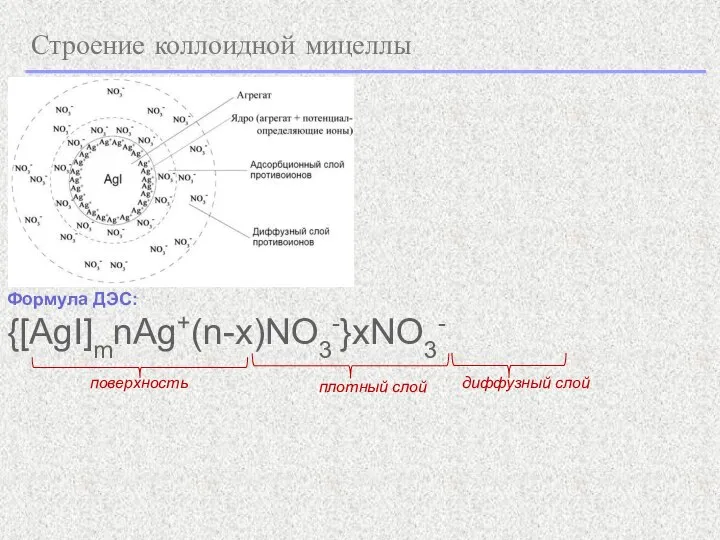
- 24. Строение коллоидной мицеллы
- 25. Строение коллоидной мицеллы Формула мицеллы {[AgI]mnAg+(n-x)NO3-}xNO3- агрегат ядро частица мицелла Мицелла в целом - электронейтральна
- 26. Запись формулы мицеллы Мицелла в целом – электронейтральна Правило Фаянса – Панета: структуру кристаллической решетки могут
- 27. Запись формулы мицеллы Мицелла в целом – электронейтральна Правило Фаянса – Панета: структуру кристаллической решетки могут
- 28. Запись формулы мицеллы Мицелла в целом – электронейтральна Правило Фаянса – Панета: структуру кристаллической решетки могут
- 30. Скачать презентацию













![Строение коллоидной мицеллы Формула мицеллы {[AgI]mnAg+(n-x)NO3-}xNO3- агрегат ядро частица мицелла Мицелла в целом - электронейтральна](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/998075/slide-24.jpg)



 Круговорот азота в природе
Круговорот азота в природе Органические соединения углеводороды
Органические соединения углеводороды Углеводороды
Углеводороды Основные положения качественного анализа. Лекция №7
Основные положения качественного анализа. Лекция №7 Опыты с водой
Опыты с водой Приобретённые: недостаточность митохондрий,
Приобретённые: недостаточность митохондрий, Водород
Водород Дисперсные системы
Дисперсные системы Лекция № 1
Лекция № 1 Ароматические углеводороды
Ароматические углеводороды Заполни электронные уровни элементов
Заполни электронные уровни элементов Химия в еде
Химия в еде ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ Основы химической термодинамики и термохимии. Лекция 3
Основы химической термодинамики и термохимии. Лекция 3 Металлы и их соединения
Металлы и их соединения История чернил
История чернил Презентация на тему Великие химики
Презентация на тему Великие химики  хімія
хімія Строение атома в ЭЖ (1)
Строение атома в ЭЖ (1) Синтетическое моторное масло. Маркировка моторных масел
Синтетическое моторное масло. Маркировка моторных масел Формирование и контроль остаточных напряжений, возникающих под действием различных технологических операций
Формирование и контроль остаточных напряжений, возникающих под действием различных технологических операций Декарбонизаторы. Декарбонизация
Декарбонизаторы. Декарбонизация Соли в природе и их значение
Соли в природе и их значение Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Предмет химии. Вещества
Предмет химии. Вещества Презентация на тему Органическая химия. История развития
Презентация на тему Органическая химия. История развития  Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион