Содержание
- 2. 2. В сегрегированном состоянии жидкость представляет собой совокупность большого числа глобул, каждая из которых содержит порядка
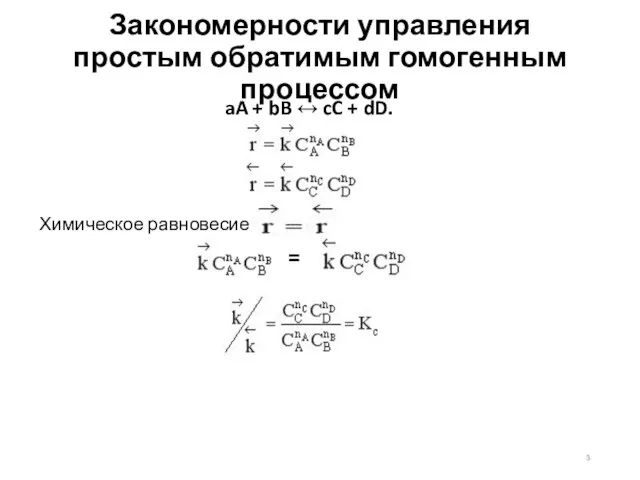
- 3. Закономерности управления простым обратимым гомогенным процессом aA + bB ↔ cC + dD. Химическое равновесие =
- 4. Для газофазных реакций pi = Ci RT Где - суммарный порядок прямой реакции - суммарный порядок
- 5. Константы Кс и Кр зависят только от температуры, константа КN еще и от давления. пределом протекания
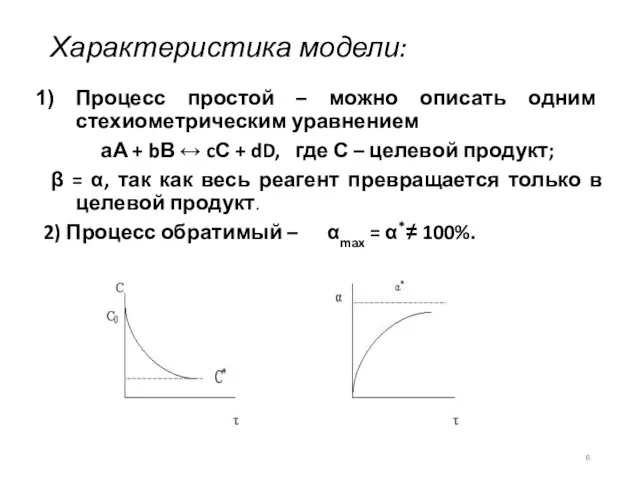
- 6. Характеристика модели: Процесс простой – можно описать одним стехиометрическим уравнением аА + bВ ↔ cС +
- 7. Процесс гомогенный – скорость процесса равна скорости химической реакции. в обратимых процессах скорость равна разности скорости
- 8. Смещение равновесия происходит только в том случае, когда произведенное воздействие неодинаково влияет на скорость прямой и
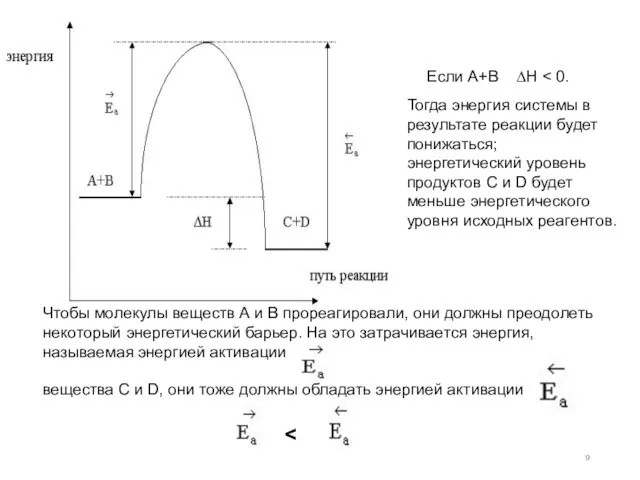
- 9. Если А+В ∆Н Тогда энергия системы в результате реакции будет понижаться; энергетический уровень продуктов С и
- 10. Если реакция взаимодействия А + В будет эндотермической, то получим такую же диаграмму, отличающуюся лишь тем,
- 11. Если прямая реакция эндотермическая, повышение температуры в большей степени увеличит константу прямой реакции; константа равновесия увеличится,
- 12. Необратимая реакция
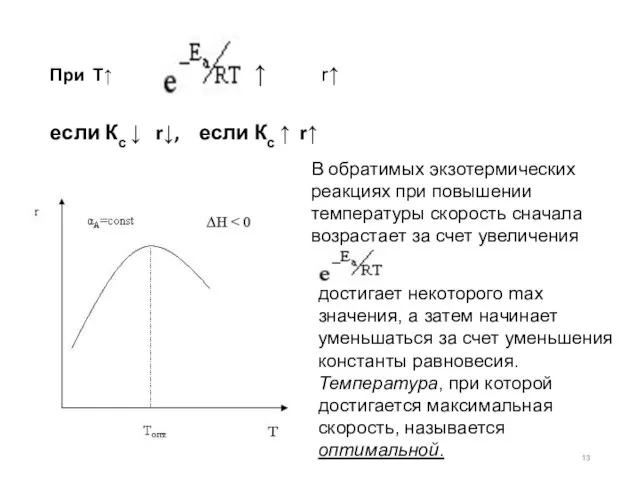
- 13. При Т↑ r↑ если Кс ↓ r↓, если Кс ↑ r↑ ↑ В обратимых экзотермических реакциях
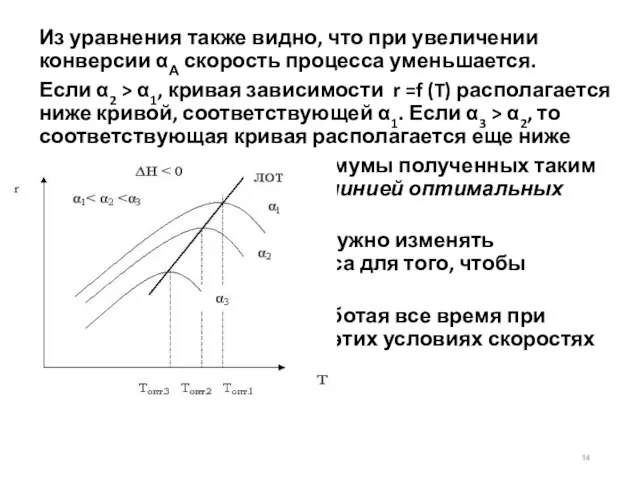
- 14. Из уравнения также видно, что при увеличении конверсии αА скорость процесса уменьшается. Если α2 > α1,
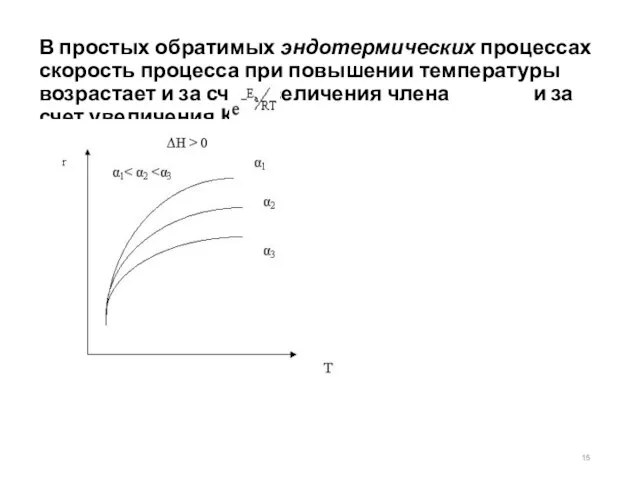
- 15. В простых обратимых эндотермических процессах скорость процесса при повышении температуры возрастает и за счет увеличения члена
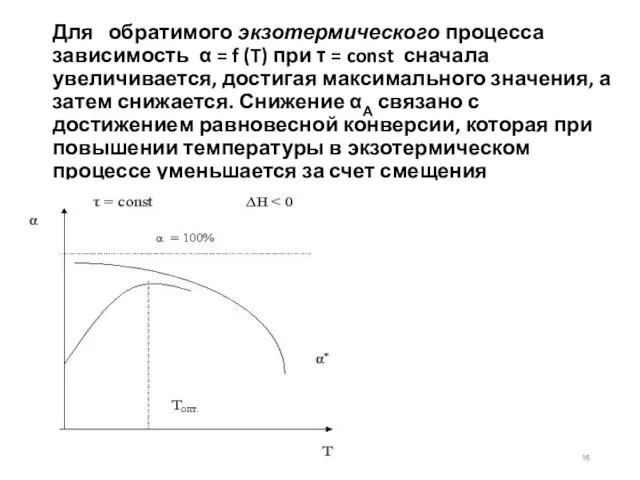
- 16. Для обратимого экзотермического процесса зависимость α = f (T) при τ = const сначала увеличивается, достигая
- 17. для обратимого экзотермического процесса не существует единой оптимальной температуры. В начале процесса нужно задавать более высокую
- 18. Для простого обратимого эндотермического процесса вопрос о влиянии температуры решается однозначно: при повышении температуры увеличивается и
- 19. Для всех кривых зависимости α = f(Т) характер изменения конверсии при невысоких температурах одинаков, поскольку в
- 20. Влияние концентрации участников реакции на скорость процесса аА + bВ → cС + dD, Суммарная скорость
- 21. Однако равновесный состав смеси будет другой. Н2 + I2 ↔ 2HI; Пусть С0 (I2) = 1
- 22. Увеличим начальную концентрацию йода: С0 (I2) = 2 моль/л; С0 (Н2) = 1 моль/л. Равновесная смесь
- 23. Значит в случае обратимого процесса также целесообразно работать с высококонцентрированным сырьем и можно использовать избыток одного
- 24. Уменьшение концентрации продуктов в реакционной смеси приводит к уменьшению скорости обратной реакции и к увеличению суммарной
- 25. Влияние давления Скорость обратимого газофазного процесса зависит от давления, причем тем больше, чем больше отличаются порядки
- 26. при р↑ r = const, если r↑, если r ↓, если Давление также влияет на положение
- 27. Если увеличение давления приводит к уменьшению КN должна увеличиться, равновесие сдвигается в сторону образования целевого продукта.
- 28. Если число молей в результате прямой реакции увеличивается, для увеличения скорости процесса и сдвига равновесия в
- 29. Выводы 1. для эффективного проведения простого обратимого гомогенного процесса необходимо не только обеспечить высокую скорость процесса,
- 31. Скачать презентацию





















 Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Реакции ионного обмена. Задания. 9 класс
Реакции ионного обмена. Задания. 9 класс Кислоты. Классификация кислот
Кислоты. Классификация кислот Основы химической термодинамики
Основы химической термодинамики Викторина Что это?
Викторина Что это? Типы химических реакций. Реакции разложения, реакции соединения.8 класс
Типы химических реакций. Реакции разложения, реакции соединения.8 класс Пластификация пластмасс
Пластификация пластмасс Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Молекулы. Свойства молекул
Молекулы. Свойства молекул Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Ионные уравнения
Ионные уравнения Современные химические топливные элементы
Современные химические топливные элементы Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Ренгеноструктурный и рентгеноспектральный анализы
Ренгеноструктурный и рентгеноспектральный анализы Алкины. Пропин
Алкины. Пропин Электролитическая диссоциация
Электролитическая диссоциация Химические реакции
Химические реакции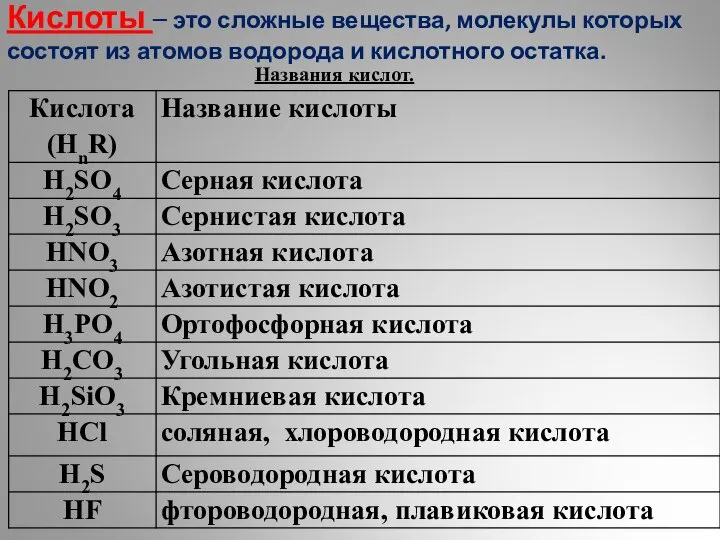 Кислоты. Классификация
Кислоты. Классификация Радиоактивные превращения. Закон радиоактивного распада. Период полураспада
Радиоактивные превращения. Закон радиоактивного распада. Период полураспада Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Общая характеристика металлов
Общая характеристика металлов Разминка для болельщиков
Разминка для болельщиков Строение электронных оболочек
Строение электронных оболочек Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Презентация на тему Химические свойства кислот
Презентация на тему Химические свойства кислот