углерода (IV)
ЯД! Он соединяется с гемоглобином, нарушая тканевое дыхание и вызывая кислородное голодание тканей.
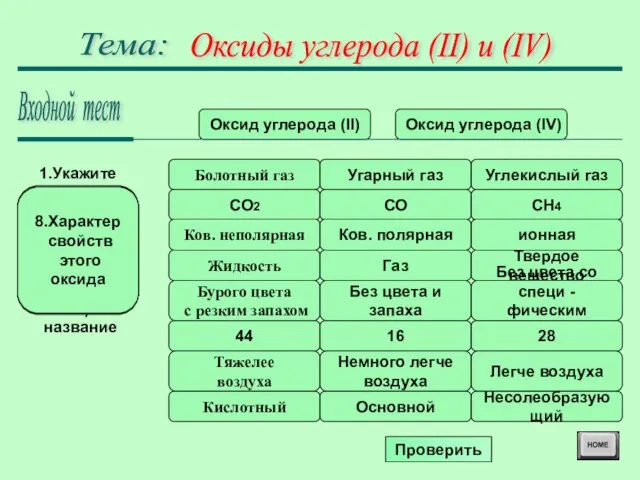
Физиологическое воздействие на человека: 0,01 - до 480 мин. - слабая . головная боль;
0,05 - до 60 мин. - тошнота, . . . . . усиленное сердцебиение;
0,1 - до 60 мин. - рвота, потеря . . сознания;
0,5 - до 20-30 мин. - смертельное . . . отравление.
Не токсичен, но не поддерживает дыхание.
Физиологическое воздействие на человека:
до 2% - до 480 мин. - учащается . дыхание;
2 - 5% - до 30 мин. -появляется шум . . в ушах, учащается пульс;
5 - 8 % - 5 - 10 мин. - сильные . . . головные боли, недомогание;
Свыше 10% - 1-2 мин. - потеря
.. . сознания, смерть.







 Непредельные углеводороды
Непредельные углеводороды Строение атома
Строение атома Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Водород
Водород Химические свойства
Химические свойства Вероятность протекания химических реакций
Вероятность протекания химических реакций Уран гексафториді
Уран гексафториді Синтез.Малахит
Синтез.Малахит Химическая связь. Строение вещества
Химическая связь. Строение вещества Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Исследование физико-химических свойств растворов сахарозы
Исследование физико-химических свойств растворов сахарозы Электролиз. Задания
Электролиз. Задания Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии
Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Строение вещества
Строение вещества Алкины
Алкины 10 класс урок № 2 ТХС
10 класс урок № 2 ТХС Stroenie_atoma__1
Stroenie_atoma__1 Физические свойства водорода
Физические свойства водорода Основы химии полимеров
Основы химии полимеров Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Полимердің тұтқырлық серпімді қасиеттері
Полимердің тұтқырлық серпімді қасиеттері Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Самостоятельная работа
Самостоятельная работа Соединения галогенов
Соединения галогенов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений