Содержание
- 2. План урока Теория электролитической диссоциации. I- е положение ТЭД. Задания к I-му положению ТЭД. II-е положение
- 3. 1. Теория электролитической диссоциации (ТЭД). В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ
- 4. 2. I-е положение ТЭД. Современное содержание ТЭД можно свести к четырем основным положениям. I-е положение: Все
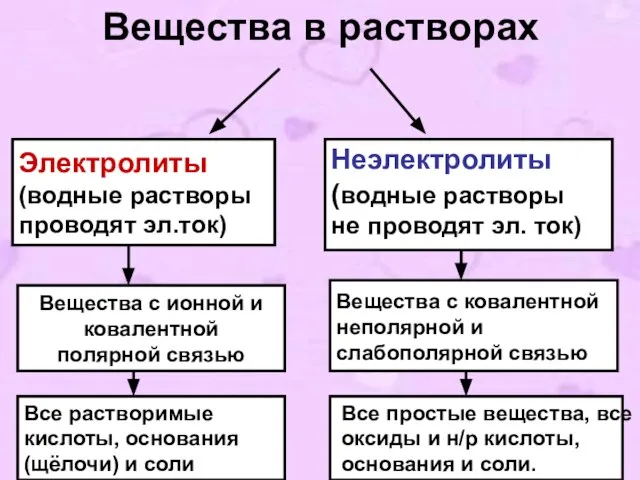
- 5. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 6. 3. Задания к I-му положению ТЭД Какие вещества называются электролитами и неэлектролитами? Назовите по два вещества,
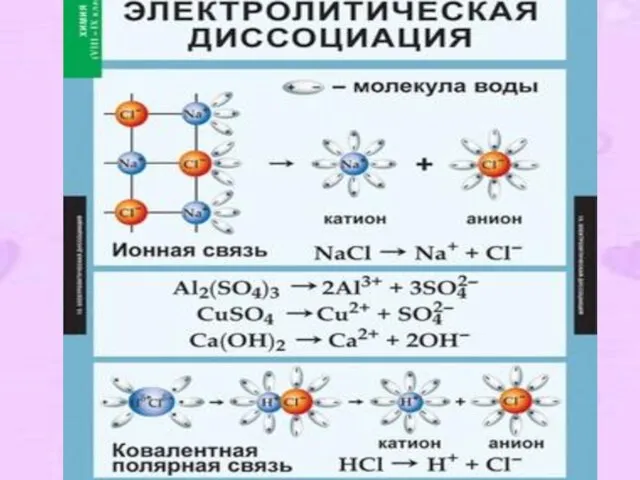
- 7. 4. II-е положение ТЭД В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы.
- 9. Механизм ЭД: Вещества с ионной связью: Ориентация диполей воды → гидратация → диссоциация. Вещества с ковалентной
- 10. Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные
- 11. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+
- 13. Скачать презентацию








 Своя игра. Атомы
Своя игра. Атомы Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Бирюза. Характеристики минерала
Бирюза. Характеристики минерала Методы разделения и очистки веществ
Методы разделения и очистки веществ Окисники, відновники
Окисники, відновники Идентификация эфедрина гидрохлорида и дэфедрина
Идентификация эфедрина гидрохлорида и дэфедрина Презентация на тему Великие химики
Презентация на тему Великие химики  Вывод и обсуждение
Вывод и обсуждение Спирты. Тест
Спирты. Тест Химические реакции. Классификация
Химические реакции. Классификация Классы неорганических соединений
Классы неорганических соединений Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Сера и его соединения
Сера и его соединения Диссоциация кислот
Диссоциация кислот Основания, их состав и название
Основания, их состав и название Периодическая система
Периодическая система Ароматические углеводороды
Ароматические углеводороды Сплавы на основе меди, титана, никеля
Сплавы на основе меди, титана, никеля Технология синтеза КТ CdSe
Технология синтеза КТ CdSe Гидролиз солей
Гидролиз солей Презентация на тему Азотная кислота (9 класс)
Презентация на тему Азотная кислота (9 класс)  Гидроксиды металлов
Гидроксиды металлов Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Химическая технология органических веществ
Химическая технология органических веществ Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Понятие о полимере. Технологии обработки пластмасс
Понятие о полимере. Технологии обработки пластмасс