Содержание
- 2. БУФЕРНЫЕ РАСТВОРЫ Организм человека располагает тонкими механизмами координации происходящих в нём процессов и поддержания постоянства внутренней
- 3. Сохранение постоянства рН жидких сред организма имеет очень важное значение для жизнедеятельности человеческого организма, т.к. ионы
- 4. БУФЕРНЫЕ РАСТВОРЫ Поддержанию на постоянном уровне концентрации ионов водорода способствуют буферные растворы – растворы, рН которых
- 5. КЛАССИФИКАЦИЯ БУФЕРНЫХ РАСТВОРОВ 1 тип буферных растворов: Ацетатный - СН3СООН и СН3СООNa Фосфатный - NaH2PO4 и
- 6. КЛАССИФИКАЦИЯ БУФЕРНЫХ РАСТВОРОВ 2 тип буферных растворов: Аммиачный – NH4OH и NH4Cl. По более современной классификации
- 7. КЛАССИФИКАЦИЯ БУФЕРНЫХ РАСТВОРОВ 3. БР, состоящие из аниона кислой и средней соли, или из анионов двух
- 8. РН БУФЕРНЫХ РАСТВОРОВ Так как любой БР содержит слабый электролит, к процессу его диссоциации можно применить
- 9. РН БУФЕРНЫХ РАСТВОРОВ Так как концентрация ионов СН3СОО- велика из-за диссоциации соли, процесс диссоциации СН3СООН по
- 10. К Кислота Н+ = соль После логарифмирования: cоль рН = рК + lg кислота ( Для
- 11. МЕХАНИЗМ БУФЕРНОГО ДЕЙСТВИЯ Если к буферному раствору добавить сильную кислоту, то ионы водорода будут соединяться с
- 12. МЕХАНИЗМ БУФЕРНОГО ДЕЙСТВИЯ Если к буферному раствору прибавить сильное основание, то ионы ОН- будут взаимодействовать с
- 13. МЕХАНИЗМ БУФЕРНОГО ДЕЙСТВИЯ СН3СООН + NaOH = СН3СООNa + H2O СН3СООН + OH- = СН3СОО- +
- 14. БУФЕРНАЯ ЁМКОСТЬ Способность буферного раствора сохранять рН при добавлении сильных кислот или щелочей не беспредельна и
- 15. БУФЕРНАЯ ЁМКОСТЬ Буферная ёмкость рассчитывается по кислоте и щёлочи ( моль/л): n(к.) В(к.) = ( рН0
- 16. БУФЕРНАЯ ЁМКОСТЬ Буферная ёмкость зависит от: природы и общих концентраций компонентов буферного раствора, а также от
- 17. БУФЕРНЫЕ СИСТЕМЫ КРОВИ Для каждой биологической жидкости характерно определённое значение рН и сохранение этого значения имеет
- 18. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Водородкарбонатная (гидрокарбонатная)- состоит из слабой Н2СО3 и сопряжённого основания НСО3-. Углекислота образуется
- 19. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Величина рН крови зависит от концентрации свободной растворённой в крови Н2СО3 и
- 20. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ При поступлении в кровь кислот( например, молочной кислоты) гидрокарбонат их нейтрализует, а
- 21. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Происходящие при этом процессы можно выразить следующей схемой: Атмосфера СО2(г) СО2(р) Н2СО3
- 22. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ У гидрокарбонатной буферной системы наибольшая взаимосвязь со всеми буферными системами и вне-,
- 23. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Фосфатная буферная система состоит из слабой кислоты Н2РО4- и сопряжённого основания НРО42-.
- 24. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Отношение НРО42- / Н2РО4- в плазме крови равно 4:1, поэтому данная буферная
- 25. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Белковые буферные системы- состоят из остатков аминокислот, которые содержат -NH2 группы, имеющие
- 26. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ Белковая и гидрокарбонатная буферные системы работают совместно: СО2 + Н2О = Н2СО3
- 27. БУФЕРНЫЕ СИСТЕМЫ ПЛАЗМЫ КРОВИ При увеличении количества ионов Н+ (при избыточном образовании молочной кислоты при гипоксии
- 28. Буферная ёмкость, определяемая белками плазмы, зависит от: концентрации белков в плазме, их вторичной и третичной структуры,
- 29. БУФЕРНЫЕ СИСТЕМЫ ЭРИТРОЦИТОВ Гемоглобиновая/оксигемоглобиновая БС, на долю которой приходится 75% буферной ёмкости крови. Гемоглобиновый буфер является
- 30. В эритроцитах система гемоглобин/оксигемоглобин играет важную роль в процессах дыхания (транспортная функция по переносу О2 к
- 31. НHb является более слабой кислотой, чем HHbO2 : К(ннb) = 6,3 10-9, K(ннbо2) = 1,12 10-7),
- 32. СОВМЕСТНОЕ ДЕЙСТВИЕ ГЕМОГЛОБИНОВОЙ И ГИДРОКАРБОНАТНОЙ БС. В капиллярах большого круга кровообращения оксигемоглобин диссоциирует и отдаёт О2
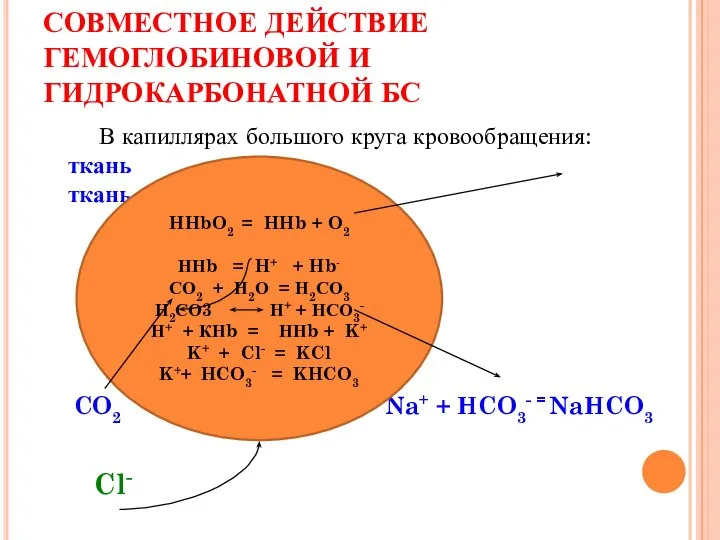
- 33. СОВМЕСТНОЕ ДЕЙСТВИЕ ГЕМОГЛОБИНОВОЙ И ГИДРОКАРБОНАТНОЙ БС. Под действием угольной ангидразы СО2 превращается в Н2СО3, при этом
- 34. СОВМЕСТНОЕ ДЕЙСТВИЕ ГЕМОГЛОБИНОВОЙ И ГИДРОКАРБОНАТНОЙ БС Часть ионов НСО3- образуют с ионами К+ соединение КНСО3, другая
- 35. СОВМЕСТНОЕ ДЕЙСТВИЕ ГЕМОГЛОБИНОВОЙ И ГИДРОКАРБОНАТНОЙ БС В капиллярах большого круга кровообращения: ткань ткань CO2 Na+ +
- 36. СОВМЕСТНОЕ ДЕЙСТВИЕ ГЕМОГЛОБИНОВОЙ И ГИДРОКАРБОНАТНОЙ БС В лёгочных капиллярах через тончайшую лёгочную мембрану по градиенту парциального
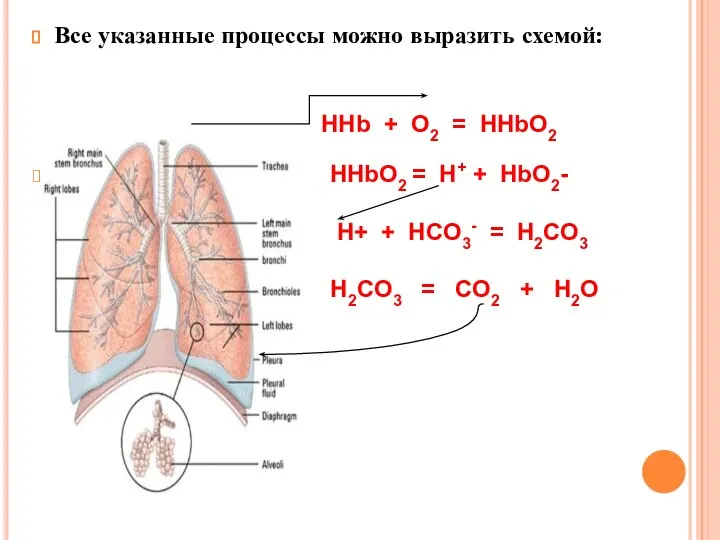
- 37. Угольная кислота под действием карбоангидразы разлагается на СО2 и Н2О. Образовавшийся СО2 переходит из эритроцитов в
- 38. Все указанные процессы можно выразить схемой: HHb + O2 = HHbO2 HHbO2 = H+ + HbO2-
- 39. Кислотно-основное состояние Таким образом, благодаря буферному действию буферных систем происходит лишь небольшое снижение рН крови, т.е.
- 40. Кислотно-основное состояние Кислотно- основное состояние организма – неотъемлемая часть гомеостаза внутренней среды организма. Физиологические системы регуляции
- 41. Ацидоз и алкалоз В зависимости от механизма развития расстройств кислотно-основного состояния выделяют дыхательный и метаболический ацидоз
- 42. повышенное образование молочной кислоты при шоке; поступление кислот с пищей, питьём, медикаментами, в результате вдыхания загрязнённого
- 44. Скачать презентацию







































 Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Алканы
Алканы Классификация веществ
Классификация веществ Методы активации карбоксильной группы
Методы активации карбоксильной группы Обобщение. Неметаллы
Обобщение. Неметаллы Щелочные металлы
Щелочные металлы Вода-растворитель
Вода-растворитель Жемчужины химии
Жемчужины химии Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Лаборатория гидрометаллургических процессов
Лаборатория гидрометаллургических процессов Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Нафтены и арены
Нафтены и арены Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение Презентация на тему Метан и его свойства
Презентация на тему Метан и его свойства  Электроотрицательность атомов
Электроотрицательность атомов Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Металлургия в химии
Металлургия в химии Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Рефолдинг миниантител
Рефолдинг миниантител Что такое кислота? Составляем общую формулу
Что такое кислота? Составляем общую формулу Презентация на тему Природный газ
Презентация на тему Природный газ  Спирты. Классификация
Спирты. Классификация Полистерол Прохоренко Е.О. 11 Б
Полистерол Прохоренко Е.О. 11 Б Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Презентация на тему Основные положения МКТ
Презентация на тему Основные положения МКТ  Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Спирты
Спирты Бериллий, магний и щелочно-земельные металлы
Бериллий, магний и щелочно-земельные металлы