Содержание
- 2. Природа и типы химических связей Установление строения атома (модели Резерфорда и Бора) дало возможность детально разработать
- 3. Природа и типы химических связей Химическая связь – это сложное электростатическое взаимодействие двух или нескольких атомов,
- 4. Природа и типы химических связей Химическая связь образуется в том случае когда один или несколько электронов
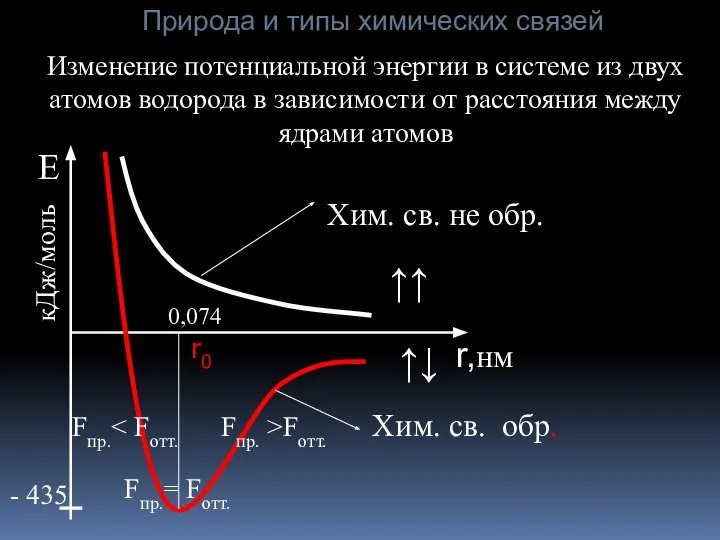
- 5. r,нм Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами
- 6. Природа и типы химических связей В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают
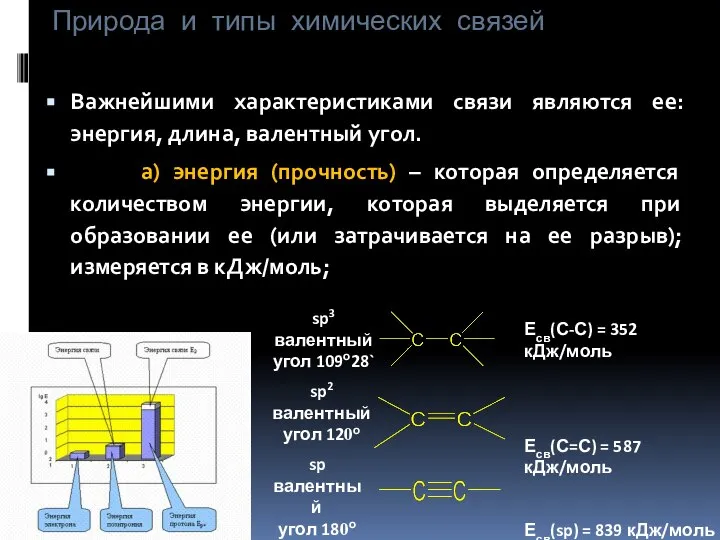
- 7. Природа и типы химических связей Важнейшими характеристиками связи являются ее: энергия, длина, валентный угол. а) энергия
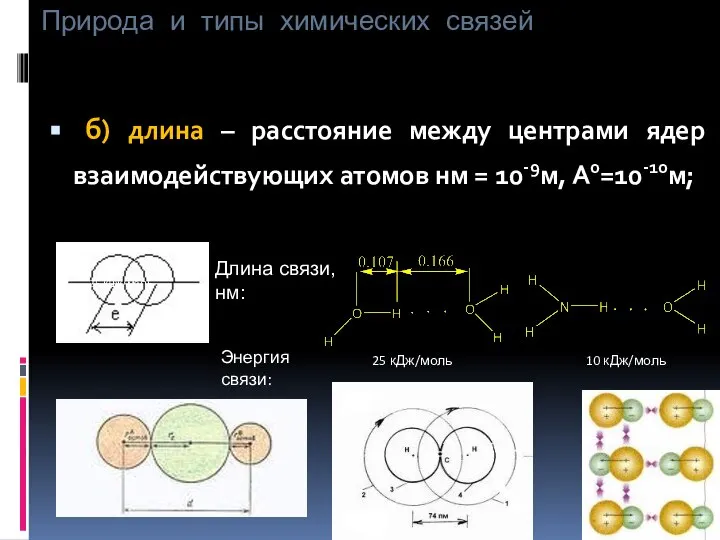
- 8. Природа и типы химических связей б) длина – расстояние между центрами ядер взаимодействующих атомов нм =
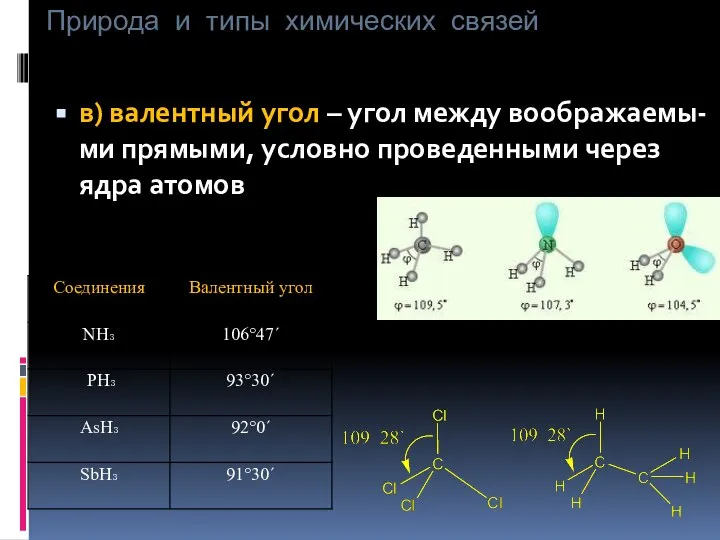
- 9. Природа и типы химических связей в) валентный угол – угол между воображаемы-ми прямыми, условно проведенными через
- 10. Природа и типы химических связей Химическая связь между атомами, возникающая за счет образования общей (общих) электронной
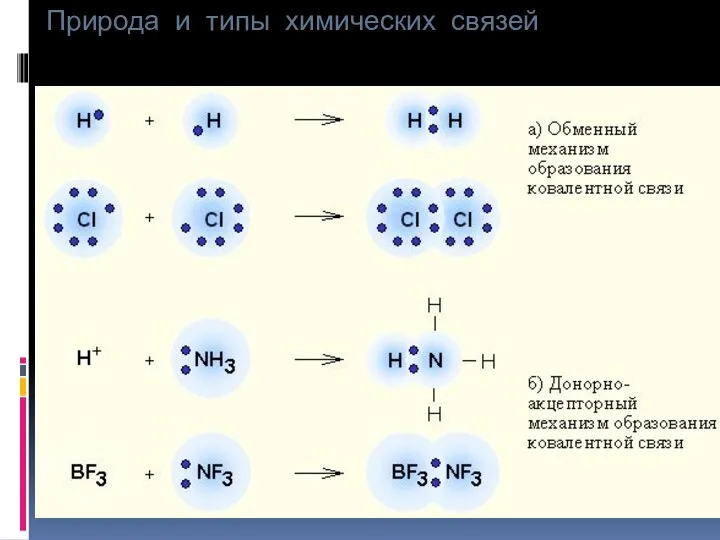
- 11. Природа и типы химических связей Существует 2 способа образования ковалентной связи (КС): а) простой (обменный) –
- 12. Природа и типы химических связей б) донорно-акцепторный – заключается в том, что в образовании связи принимают
- 13. Природа и типы химических связей
- 14. Природа и типы химических связей КС характеризуется: а) насыщенностью; б) направленностью; в) поляризуемостью.
- 15. Природа и типы химических связей Под насыщенностью КС понимают способность атома образовывать только строго ограниченное число
- 16. Природа и типы химических связей Насыщаемость ковалентной связи: атомы образуют ограниченное число связей, равное их валентности.
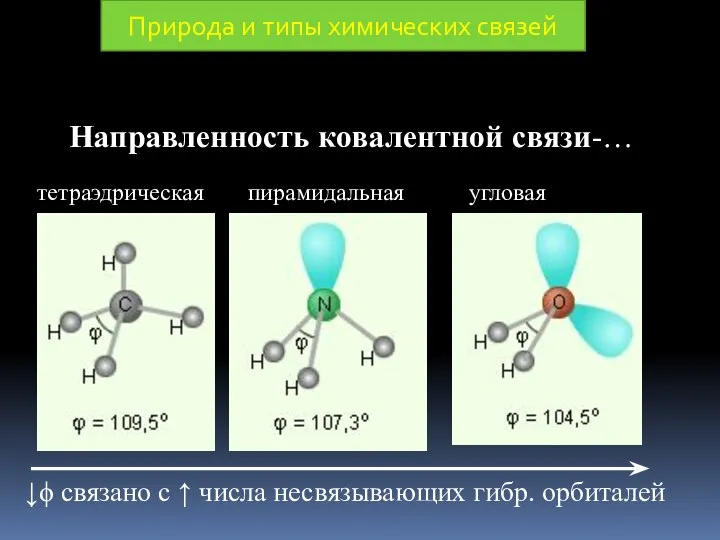
- 17. Природа и типы химических связей Под направленностью КС понимают, то, что максимально глубокое перекрывание валентных орбиталей
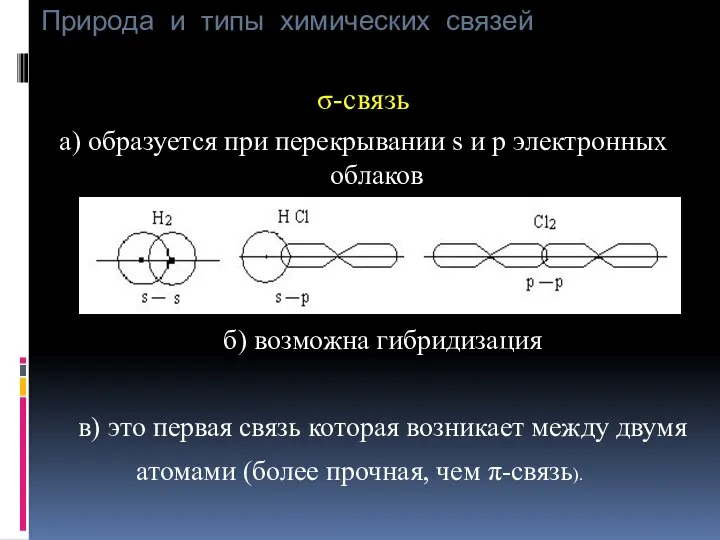
- 18. Природа и типы химических связей σ-связь а) образуется при перекрывании s и p электронных облаков б)
- 19. Природа и типы химических связей π - связь: а) образуется при перекрывании р–р электронных облаков по
- 20. Природа и типы химических связей г) π - связь менее прочная чем σ, но усиливает ее
- 21. Направленность ковалентной связи-… Природа и типы химических связей
- 22. Природа и типы химических связей
- 23. Природа и типы химических связей КС может быть неполярной и полярной Неполярная КС образуется между атомами
- 24. Природа и типы химических связей Полярная КС образуется между атомами разных элементов (вода, аммиак, углекислый газ).
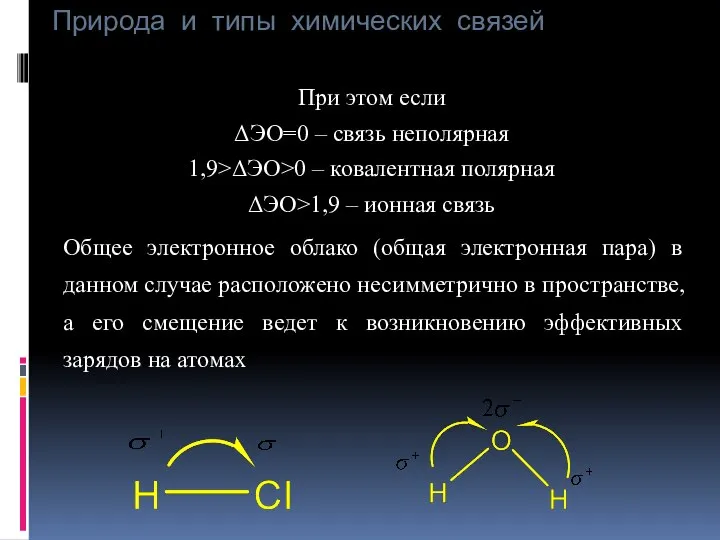
- 25. Природа и типы химических связей При этом если ΔЭО=0 – связь неполярная 1,9>ΔЭО>0 – ковалентная полярная
- 26. Природа и типы химических связей Такая молекула представляет собой диполь (т. е. систему состоящую из зарядов
- 27. Неполярные молекулы Молекула неполярна, если суммарный μ всех связей = 0. Природа и типы химических связей
- 28. Полярные молекулы Природа и типы химических связей
- 29. Дипольный момент молекулы зависит: ∙от полярности связей; ∙от геометрии молекулы; ∙от наличия неподелённых пар электронов. Природа
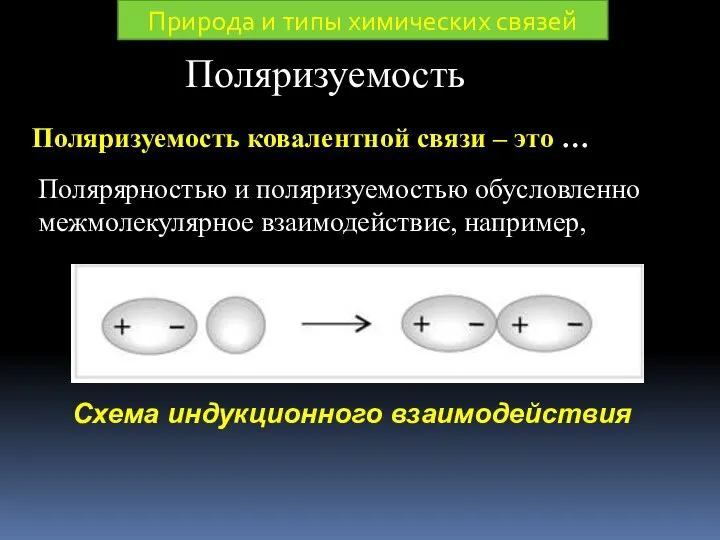
- 30. Поляризуемость Поляризуемость ковалентной связи – это … Полярярностью и поляризуемостью обусловленно межмолекулярное взаимодействие, например, Природа и
- 31. HCl HBr HI ΔЭО: 0,9 0,7 0,5 Полярность связи уменьшается Поляризуемость увеличивается Природа и типы химических
- 32. Природа и типы химических связей При устранении внешнего воздействия диполь исчезает. При длительном воздействии его может
- 33. Природа и типы химических связей Теория гибридизации была предложена в 1930 году Лайнусом Полингом и является
- 34. Природа и типы химических связей sp3-гибридизация на примере СН4 (именно рассмотрение строения молекулы СН4) привело Полинга
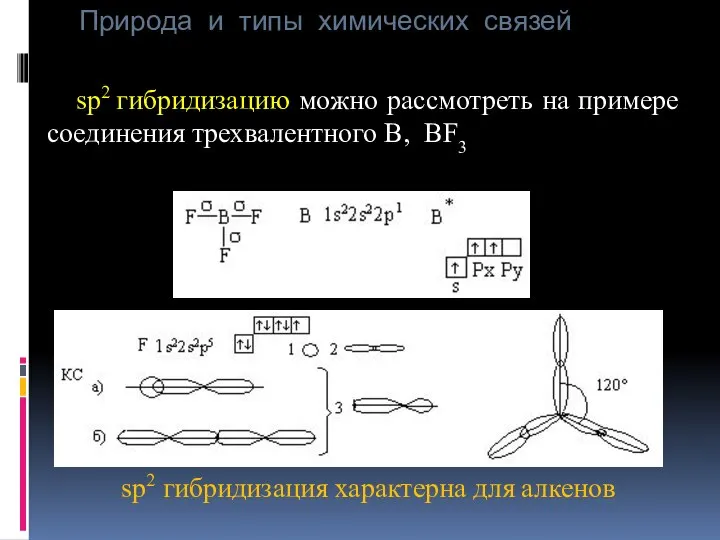
- 35. Природа и типы химических связей sp2 гибридизацию можно рассмотреть на примере соединения трехвалентного В, BF3 sp2
- 36. Природа и типы химических связей sp гибридизацию можно рассмотреть на примере молекулы BeCl2 sp гибридизация характерна
- 37. Природа и типы химических связей Химическая связь образованная за счет электростатического взаимодействия ионов называется ионной связью.
- 38. Природа и типы химических связей Механизм образования Na 1s22s2p63s1 – e Na+←2s22p6 электростатические силы взаимодействия Cl
- 39. Природа и типы химических связей Ионные соединения в целом представляет собой гигантскую ассоциацию ионов противоположных знаков.
- 40. Природа и типы химических связей Все металлы (за исключением Hg) являются кристаллическими веществами. Металлическая связь обусловлена
- 41. Природа и типы химических связей Для металлов характерно наличие: а) небольшого числа валентных ; б) большого
- 42. Природа и типы химических связей Водородная связь это связь между молекулами или частями молекулы в состав
- 43. Взаимодействие между молекулами НХ: сильно ЭО элемент: F, O, N, (Cl, S ) Природа и типы
- 44. Механизм образования Н-связи: - Электростатическое взаимодействие (диполь-дипольное) -Донорно-акцепторное взаимодействие: -направленность -насыщаемость Природа и типы химических связей
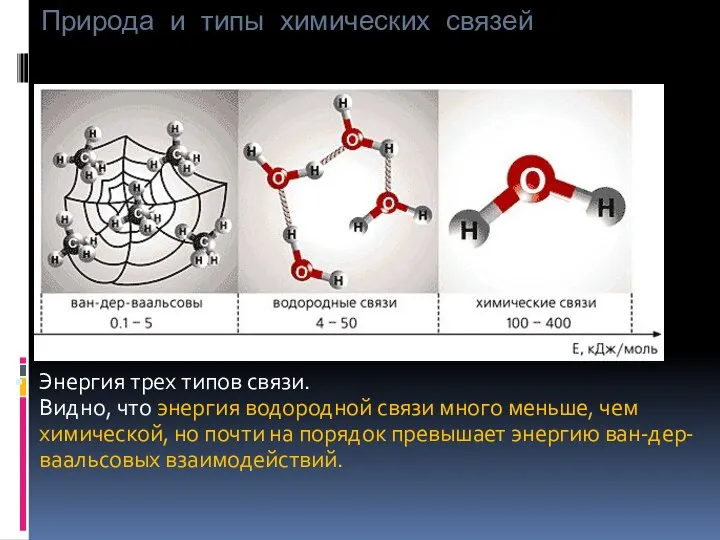
- 45. Есвязи, кДж/моль ковалентная 100-400 водородная 4-50 межмолекулярная 0,1 -5 Энергия Н-связи Природа и типы химических связей
- 46. Природа и типы химических связей Энергия трех типов связи. Видно, что энергия водородной связи много меньше,
- 47. Природа и типы химических связей Водородная связь может быть 2 типов: - межмолекулярная. H2O, HF, NH3
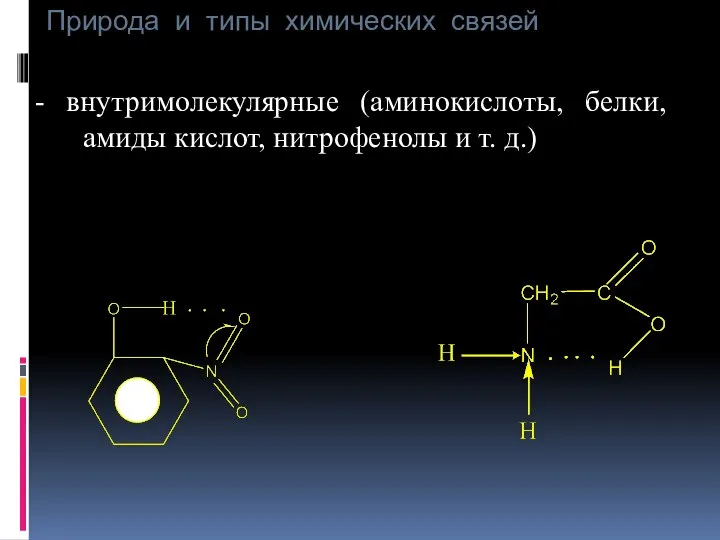
- 48. Природа и типы химических связей - внутримолекулярные (аминокислоты, белки, амиды кислот, нитрофенолы и т. д.)
- 50. Скачать презентацию



































 Химические свойства воды
Химические свойства воды Металлы: общая характеристика
Металлы: общая характеристика Полиморфизм. Аллотропия
Полиморфизм. Аллотропия Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Гипер-гипофосфатемия
Гипер-гипофосфатемия Степень окисления
Степень окисления Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества
Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества Тема_6б_химическая_кинетика
Тема_6б_химическая_кинетика Вода в природе
Вода в природе Кислоты. Химический диктант. 8 класс
Кислоты. Химический диктант. 8 класс Валенттілік. Атом-молекулалы ілім
Валенттілік. Атом-молекулалы ілім Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Химическая связь 11 класс - Презентация_
Химическая связь 11 класс - Презентация_ Основные понятия химии
Основные понятия химии Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Обобщение знаний об основных классах неорганических соединений
Обобщение знаний об основных классах неорганических соединений Что такое бинарные соединения?
Что такое бинарные соединения? Презентация на тему Химия и музыка 11 класс
Презентация на тему Химия и музыка 11 класс  Модульная технология на уроках химии
Модульная технология на уроках химии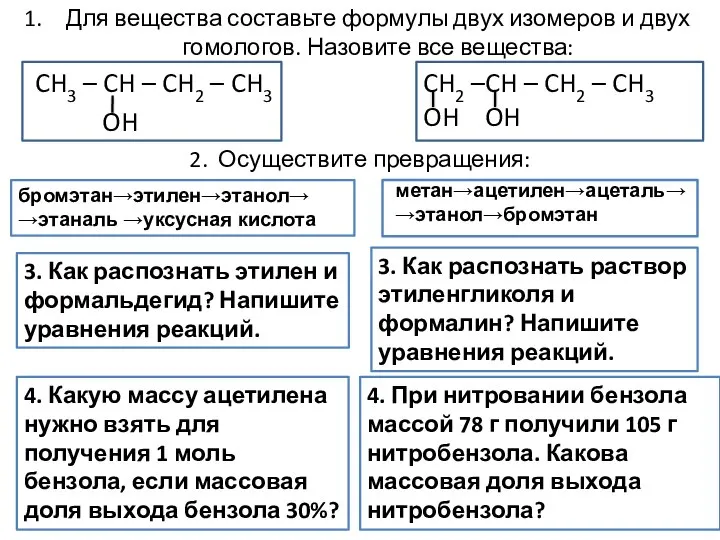 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Воздействие слюны на крахмал
Воздействие слюны на крахмал Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде Амины
Амины Кальций
Кальций Охрана родников Ногликского района и анализ воды из этих родников
Охрана родников Ногликского района и анализ воды из этих родников Повторение по химии (8 класс)
Повторение по химии (8 класс) Химические элементы
Химические элементы