Содержание
- 2. Определения и классификация Номенклатура Физические свойства Способы получения Химические свойства соли
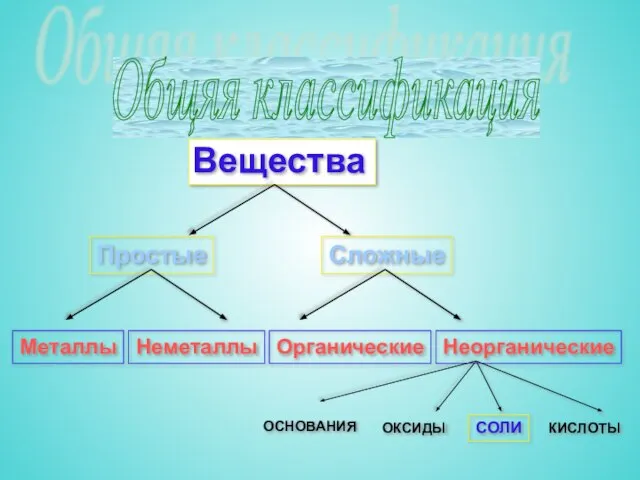
- 3. Общяя классификация Простые Сложные Металлы Неметаллы Органические Неорганические ОСНОВАНИЯ ОКСИДЫ СОЛИ КИСЛОТЫ
- 4. Классификация солей соли средние кислые основные двойные смешанные комплексные гидратные
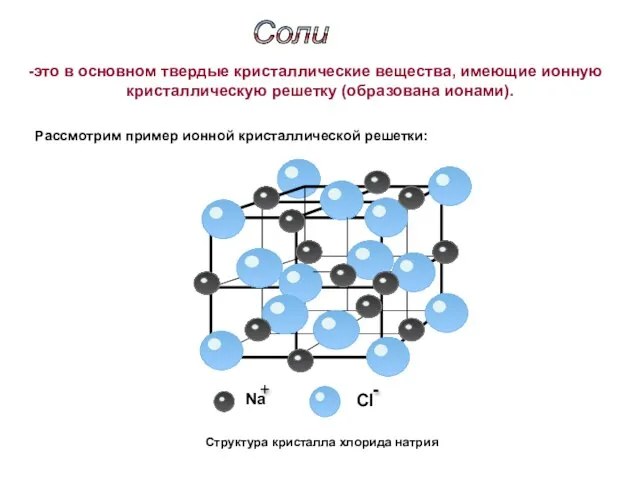
- 5. Структура кристалла хлорида натрия Соли это в основном твердые кристаллические вещества, имеющие ионную кристаллическую решетку (образована
- 6. Определения типов солей Соли состоят из атомов металла и атомов кислотного остатка. Основные типы солей это:
- 7. Примеры солей Средние соли: Ca(NO3)2; K2SO4; Al(NO3)3. Кислые соли: KHSO4; MgHPO4; NaSO3. Основные соли: LiOHPO4; CaOHP2O
- 8. а) К основным солям б) К смешанным солям в) К комплексным солям г) К двойным солям
- 9. Номенклатура солей Название солей образуется из названия аниона, за которым следует название катиона. Для солей бескислородных
- 10. Как правильно назвать соль: KCl? а) Хлор калия б) Хлорид калия в) Хлорат калия г) Хлорит
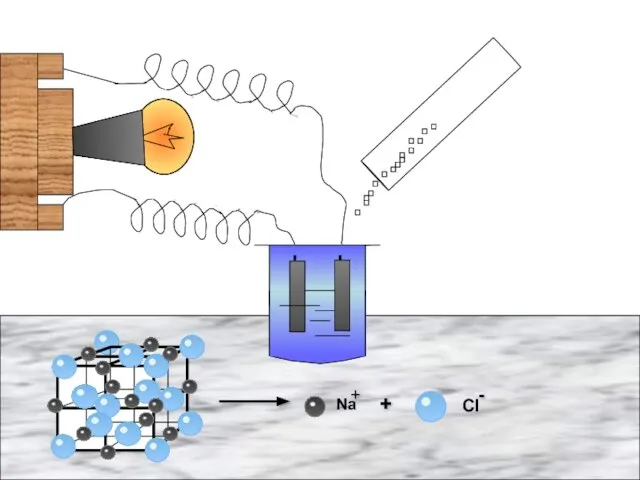
- 11. Физические свойства солей Основное свойство солей- это то, что они являются электролитами. Электролиты- это вещества, растворы
- 12. +
- 13. Способы получения солей Соли получают разнообразными способами. Вот примеры некоторых из них: а) Взаимодействием двух простых
- 14. Химические свойства солей Соли обладают общими химическими свойствами за счет сходного иона. Пример: Взаимодействие солей с
- 15. С каким из металлов будет взаимодействовать соль MgS? а) Ca б) Mn в) Zn г) Ni
- 16. Гидролиз солей Существуют четыре типа гидролиза: Соль образована ионом сильного основания и ионом слабой кислоты. 2)Соль
- 17. План составления гидролиза: 1) Проверить соль на растворимость по таблице растворимости. 2) Определить, есть ли в
- 18. Первый тип гидролиза Пример:
- 19. Второй тип гидролиза Пример:
- 20. Третий тип гидролиза В этом случае гидролиз необратим. Примеры:
- 21. Четвертый тип гидролиза NaCl Растворимые соли, образованные сильной кислотой и сильным основанием, в воде не гидролизируются.
- 22. Факторы, влияющие на гидролиз 1) Повышение температуры приводит к смещению равновесия в сторону продуктов реакции. 2)Увеличение
- 23. КОНЕЦ! P.S. Надеюсь, Вам понравилось.
- 24. ВЕРНО
- 25. Не верно
- 26. Не верно
- 27. ВЕРНО
- 28. ВЕРНО
- 30. Скачать презентацию
























 Амины. Способы получения
Амины. Способы получения Вода - растворитель
Вода - растворитель Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Кремень. Нахождение в природе
Кремень. Нахождение в природе Углеводороды. Алканы
Углеводороды. Алканы Металлы d-элементы
Металлы d-элементы Водородная химическая связь
Водородная химическая связь Природные и искусственные материалы. Естествознание. 6 класс
Природные и искусственные материалы. Естествознание. 6 класс Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Синтетические душистые вещества
Синтетические душистые вещества Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Презентация на тему Классификация полимеров
Презентация на тему Классификация полимеров  Магний (Mg)
Магний (Mg) Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Селективное каталитическое восстановление оксидов азота
Селективное каталитическое восстановление оксидов азота Презентация на тему Химические реакции
Презентация на тему Химические реакции  Презентация по Химии "Алмаз"
Презентация по Химии "Алмаз"  Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Общие сведения о питании и приготовлении пищи
Общие сведения о питании и приготовлении пищи Кислоты
Кислоты Металлы. Определения
Металлы. Определения Indikatori. R. Boila eksperiments
Indikatori. R. Boila eksperiments Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Алкины и их свойства
Алкины и их свойства Химическая кинетика. Факторы, влияющие на скорость реакции
Химическая кинетика. Факторы, влияющие на скорость реакции