Слайд 2Тема урока
«Я держу в страхе металлы и сплавы всего мира. Более 20

млн тонн в год — примерно 15 % всех производимых в мире металлов становятся ежегодно моими жертвами. по подсчетам экономистов, ущерб, наносимый мною, во много раз превышает даже потери от такого страшного стихийного бедствия, как пожары?! Это и неудивительно: ведь огонь буйствует сравнительно редко, а я действую постоянно, ни на одно мгновение не прекращая свою подрывную деятельность.
Существенные убытки я причиняю и косвенно. Вспомните хотя бы утечку нефти или газа из съеденного мною трубопровода. Я досрочно вывожу из строя детали, оборудование и целые сооружения.»
Слайд 3Коррозия
«Просто знать — еще не все, знания нужно уметь использовать».
Гёте

Слайд 4Коррозия - это разрушение металла под действием внешней среды.
Этот процесс имеет

окислительно-восстановительный характер.
В роли окислителя, как правило, выступают О2 и Н+, при этом атомы металла превращаются в ионы:
Ме⁰ - nḗ → Ме⁺ⁿ
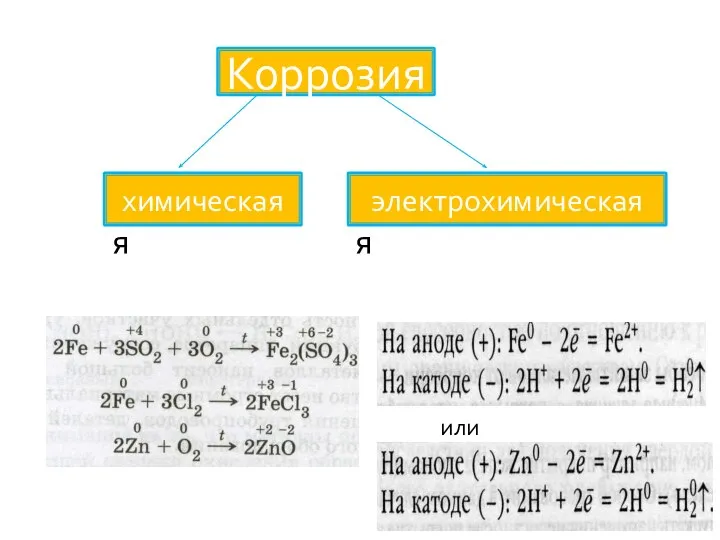
Слайд 5химическая
электрохимическая
химическая
электрохимическая
Коррозия
или
Слайд 6
химическая коррозия
Химическая коррозия протекает в средах,
не проводящих электрический ток
(например, газы,

нефть), при высоких температурах, когда невозможна конденсация водяного пара.
Ей подвергаются арматура печей, детали
двигателей внутреннего сгорания, лопатки газовых турбин, аппаратура химической промышленности.
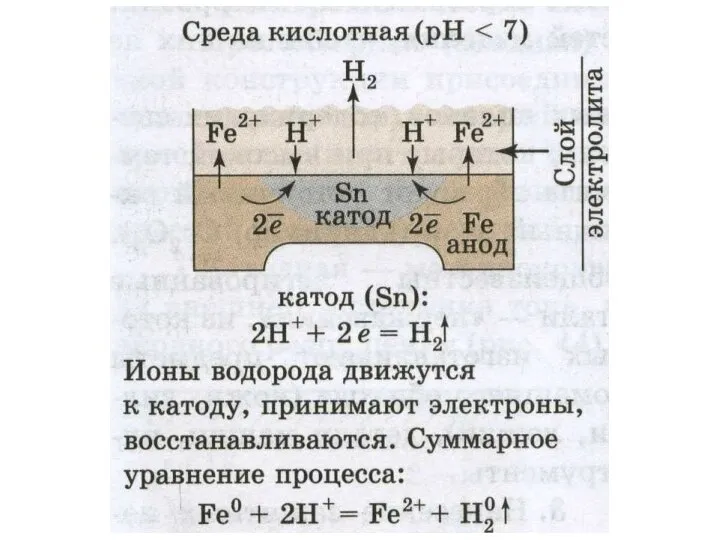
Слайд 7Электрохимическая коррозия
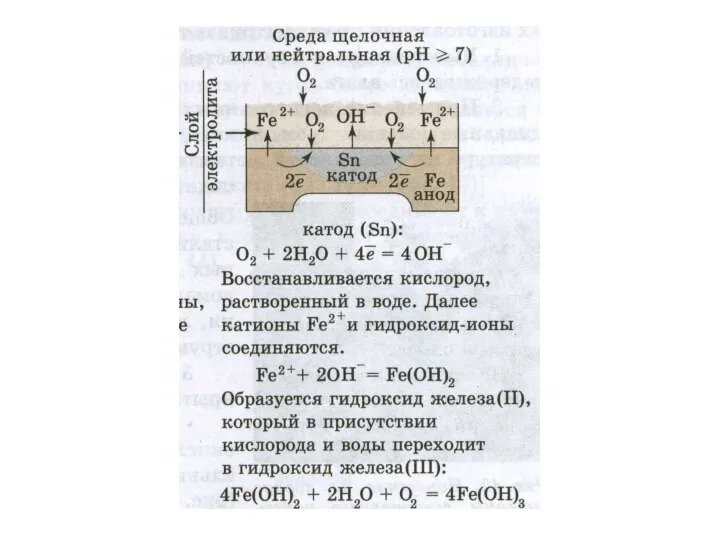
Электрохимическая коррозия протекает в присутствии влаги.
Ей подвергаются подводные части судов

в морской и пресной воде, паровые котлы,
металлические сооружения и конструкции под водой и в атмосфере, проложенные
в грунте трубопроводы, оболочки кабелей и др.
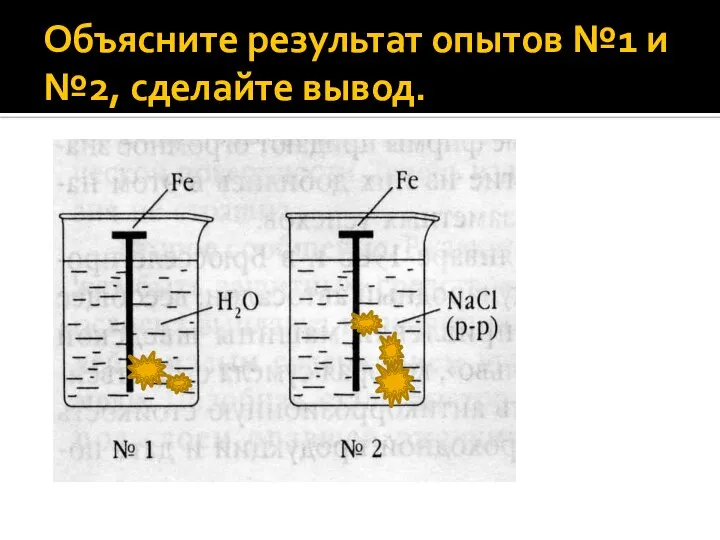
Слайд 8Объясните результат опытов №1 и №2, сделайте вывод.
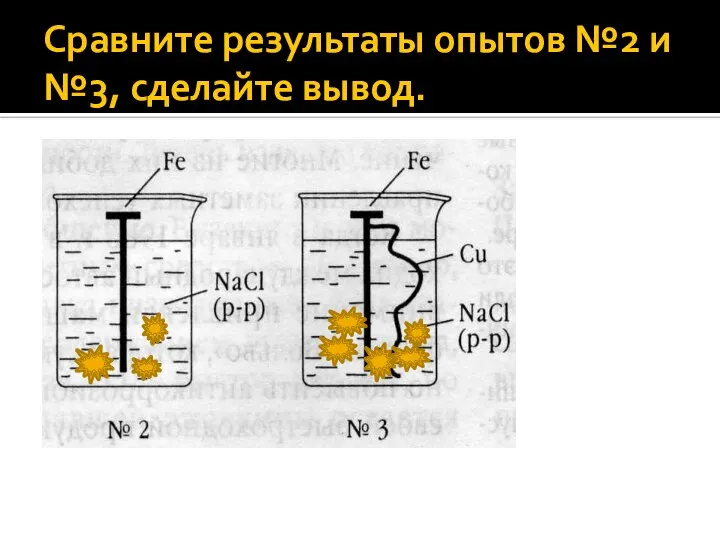
Слайд 9Сравните результаты опытов №2 и №3, сделайте вывод.
Слайд 10Сравните результаты опытов №3 и №4, сделайте вывод.

Слайд 11Сравните результаты опыта №2 и №5, сделайте вывод.

Слайд 14Способы защиты металлов от коррозии
Анодная защита — покрытие металла более активным металлом.

Например, в гальванической паре Zn—Fe (оцинкованное железо) защищено железо, в паре Zn-Cu защищена медь и т. д. Как частный случай анодной защиты можно рассматривать протекторную защиту. Например, к днищам кораблей прикрепляют протекторы — слитки более активного металла (чаще всего цинка), чем тот, из которого выполнена обшивка днища корабля.
Слайд 15Катодная защита
— защита менее активным металлом, например покрытие железа оловом (луженое железо).

Особое требование в данном случае — не допускать нарушения целостности покрытия.
Изготовление сплавов, стойких к коррозии.
Слайд 16Отделение металла от агрессивной среды
(окраска, смазка, покрытие лаками, эмалями). Ученые создали новое

стеклокристаллическое покрытие, которое отличается стойкостью и способностью работать при более высокой, чем металлы, температуре.
Использование ингибиторов. Чаще всего это органические вещества или неорганические соли (дихромат и нитрат натрия, хроматы стронция, свинца, цинка и др.).
Слайд 17Электрозащита
— нейтрализация тока, возникающего при коррозии, постоянным током, пропускаемым в противоположном направлении.

Защищаемую конструкцию присоединяют к катоду внешнего источника тока, а анод заземляют. Так обычно защищают трубы нефте- и газопроводов.
Слайд 18Пассивация металлов
— это образование на поверхности металла плотно прилегающего оксидного слоя, защищающего

от коррозии. Например, железо пассивируют погружением изделия в концентрированную азотную кислоту. Пассивированное железо перестает взаимодействовать с кислотами с выделением водорода. Устранить пассивацию можно разрушением пленки.
Слайд 19Может ли ржавчина быть полезной для металла?
Любопытную технологию превращения слоя ржавчины в

защитное покрытие удалось разработать индийским ученым. Для этого на стальное изделие, покрытое густым налетом ржавчины, наносят специальный состав, который превращает слой оксидов в прочный панцирь черного цвета. Затем на него наносят краску. Кстати, на этом защитном слое краска держится надежнее, чем непосредственно на металлической поверхности. Теперь изделию коррозия не страшна.
Слайд 20История вопроса
В начале 30-х гг. XX в. советский ученый А. Н. Фрумкин,

изучая амальгамы металлов, показал, что активный металл амальгамы растворяется в кислотах, хотя амальгама однородна и не имеет никаких включений. В 1935 г. А. И. Шултин объяснил коррозию как индивидуальных металлов, так и сплавов. Он предложил механизм процесса коррозии и выявил факторы, влияющие на его скорость. В том же 1935 г.
Я. В. Дурдин также высказал и обосновал идею о растворении металлов в кислотах без наличия инородных включений в них. Таким образом, именно советские ученые сформулировали теорию электрохимической коррозии металлических материалов.
Слайд 21Ответьте на вопросы:
Что такое коррозия? Какие виды коррозии вы знаете?
Когда и кем

была создана теория коррозии металлов?
При каких условиях коррозия протекает особенно интенсивно?
Как можно замедлить коррозию металлов?
Чистый цинк не растворяется в разбавленной серной кислоте, а если прибавить несколько капель сульфата меди, начинает энергично выделять водород. Объясните это явление.
Почему луженый бак в местах повреждения быстро ржавеет, а оцинкованный при тех же условиях не разрушается?
Почему рядом со стальной коронкой не рекомендуют ставить золотую?
Слайд 22Творческое домашнее задание:
объяснить химические процессы, о которых идет речь в отрывке из

стихотворения А. Ахматовой.)
На рукомойнике моем
Позеленела медь,
Но так играет луч на нем,
Что весело глядеть.



















 Степени окисления и формулы веществ
Степени окисления и формулы веществ Analysis of proteins
Analysis of proteins Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Галоген тобы бар полимерлер
Галоген тобы бар полимерлер Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения  Комісія хімічних дисциплін
Комісія хімічних дисциплін Выращивание кристаллов соли и сахара в домашних условиях
Выращивание кристаллов соли и сахара в домашних условиях Поливиниловый спирт
Поливиниловый спирт Неметаллы
Неметаллы Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Презентация на тему Строение атомного ядра
Презентация на тему Строение атомного ядра  Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Альдегиды и кетоны
Альдегиды и кетоны Структура и свойства чистого титана
Структура и свойства чистого титана бирюза
бирюза Схема реакций
Схема реакций Кислоты. 8 клас
Кислоты. 8 клас Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Полимеры и пластмассы
Полимеры и пластмассы Спирты. К кроссворду
Спирты. К кроссворду Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Занимательная химия Программу составил
Занимательная химия Программу составил  Кремень – камень
Кремень – камень DOC-20221011-WA0003
DOC-20221011-WA0003 Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ