Содержание
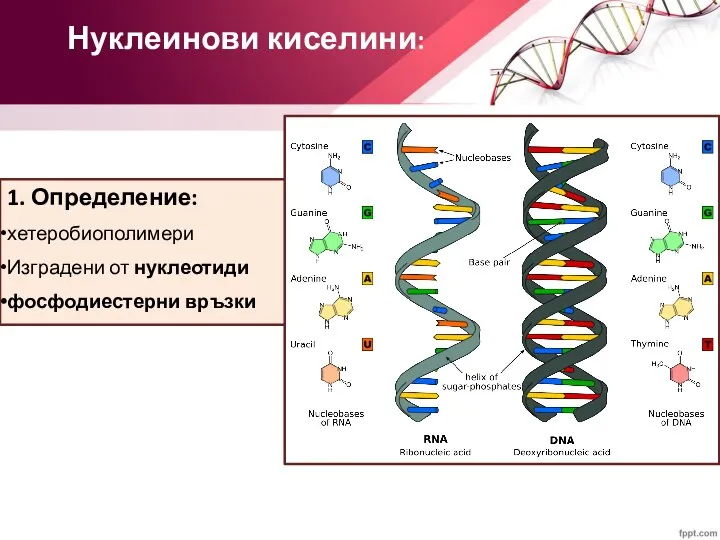
- 2. Нуклеинови киселини: 1. Определение: хетеробиополимери Изградени от нуклеотиди фосфодиестерни връзки
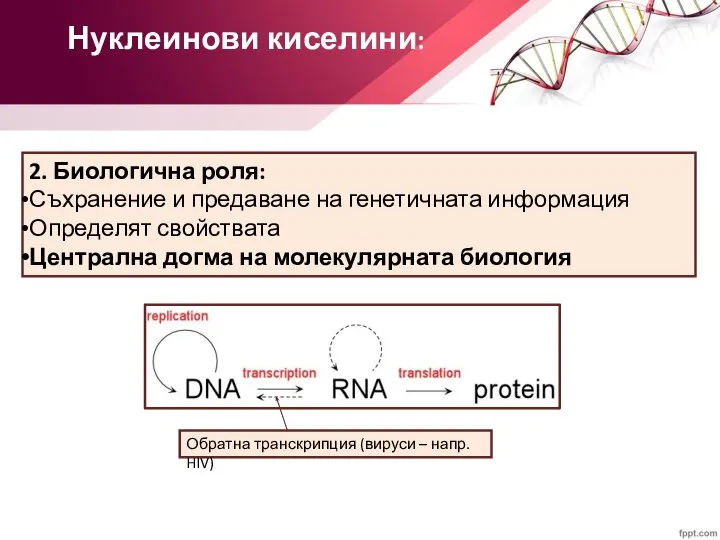
- 3. Нуклеинови киселини: 2. Биологична роля: Съхранение и предаване на генетичната информация Определят свойствата Централна догма на
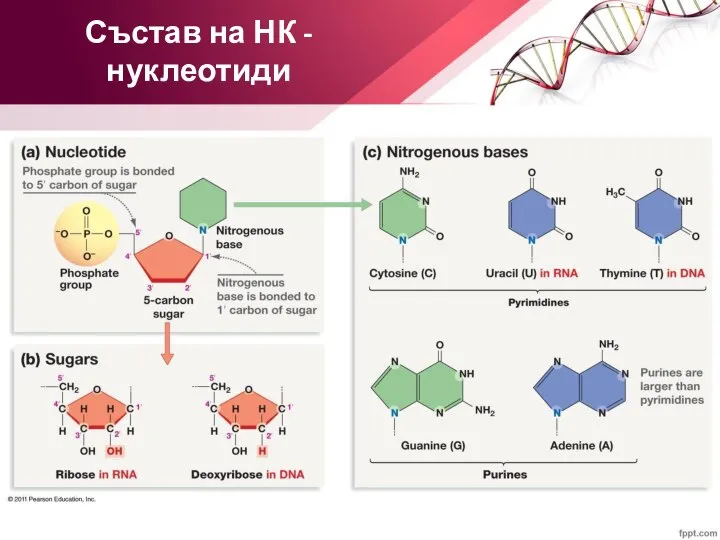
- 4. Състав на НК - нуклеотиди
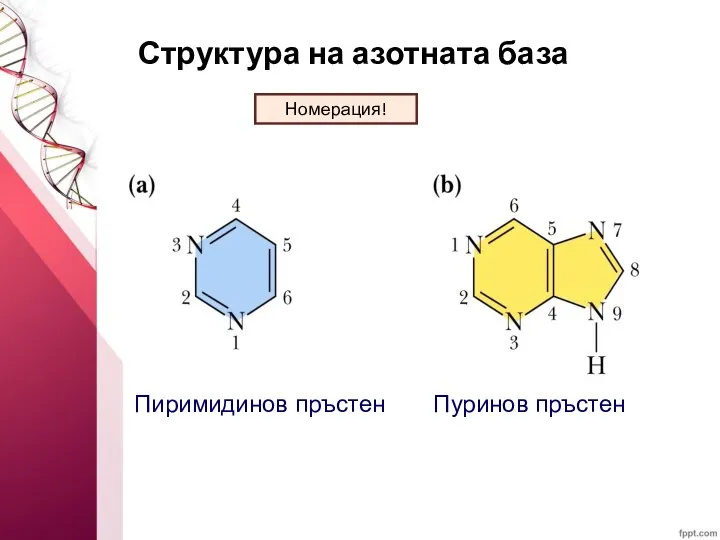
- 5. Структура на азотната база Пиримидинов пръстен Пуринов пръстен Номерация!
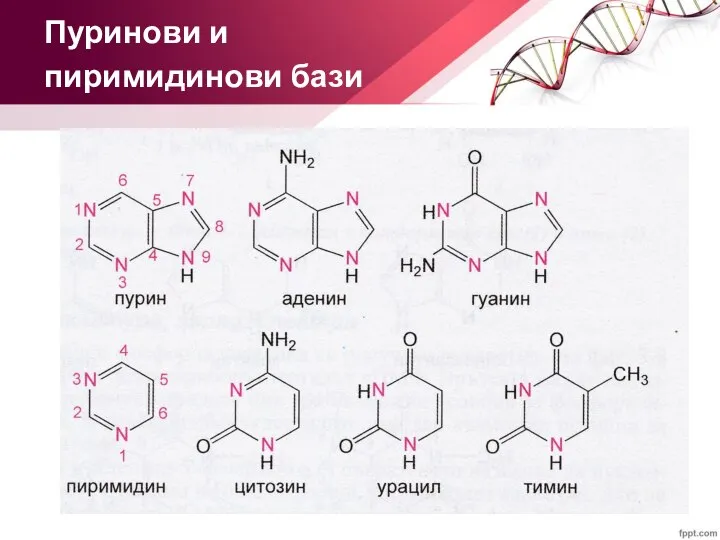
- 6. Пуринови и пиримидинови бази
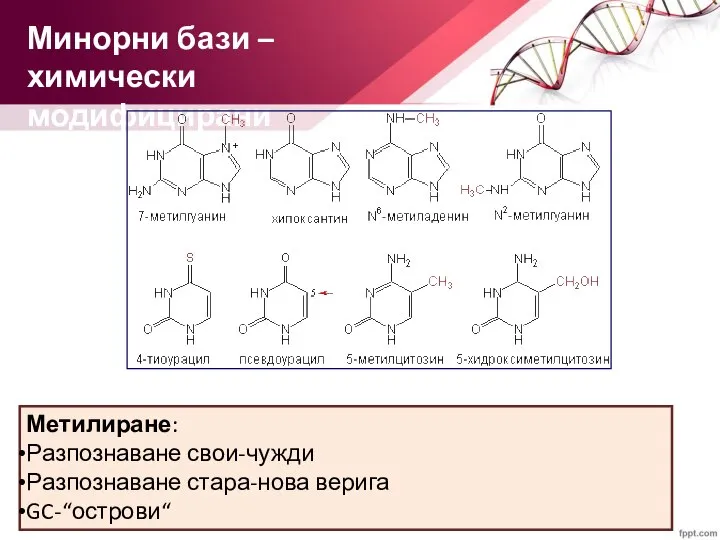
- 7. Минорни бази – химически модифицирани Метилиране: Разпознаване свои-чужди Разпознаване стара-нова верига GC-“острови“
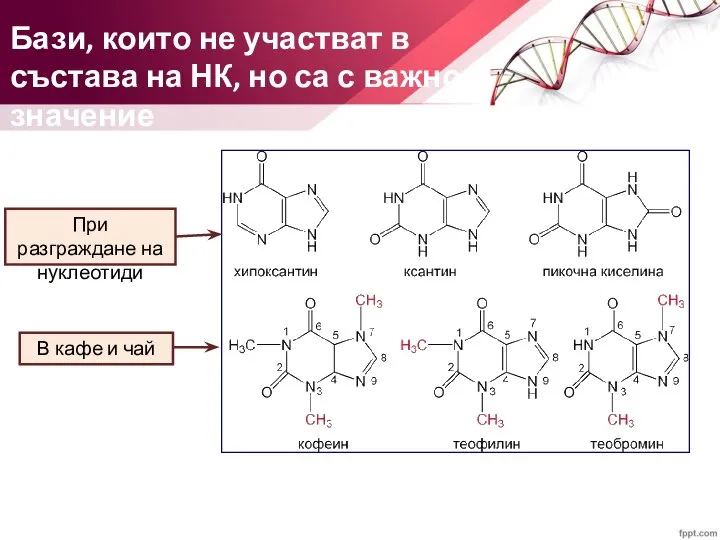
- 8. Бази, които не участват в състава на НК, но са с важно значение При разграждане на
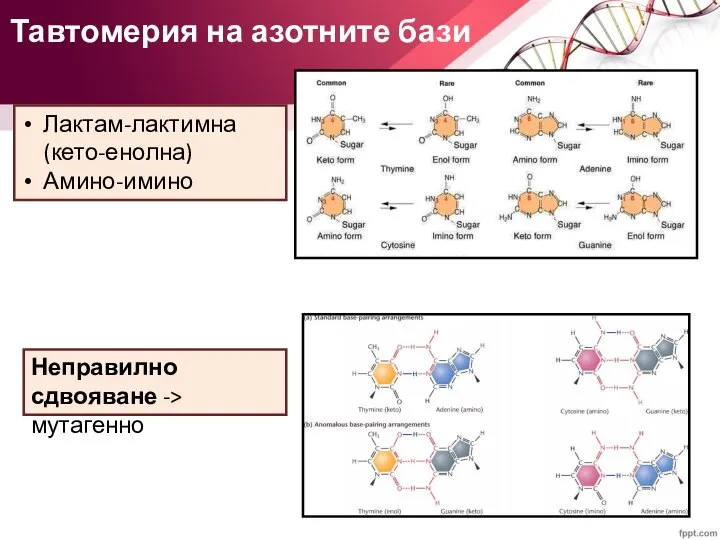
- 9. Тавтомерия на азотните бази
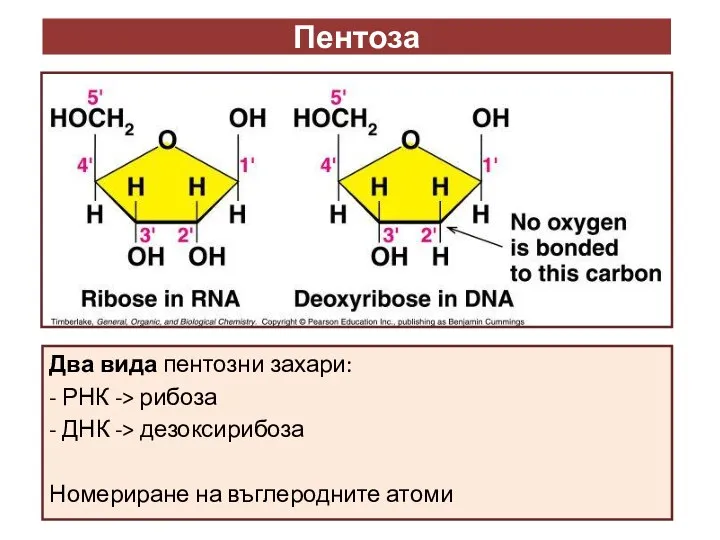
- 10. Пентоза Два вида пентозни захари: - РНК -> рибоза - ДНК -> дезоксирибоза Номериране на въглеродните
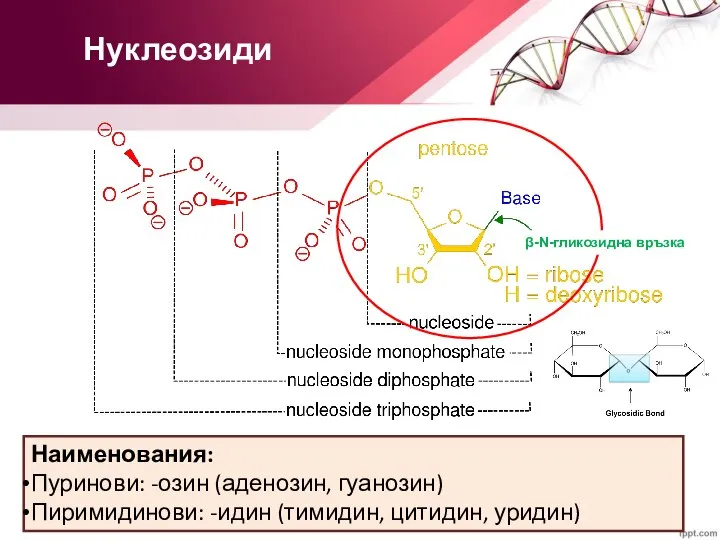
- 11. Нуклеозиди Наименования: Пуринови: -озин (аденозин, гуанозин) Пиримидинови: -идин (тимидин, цитидин, уридин) β-N-гликозидна връзка
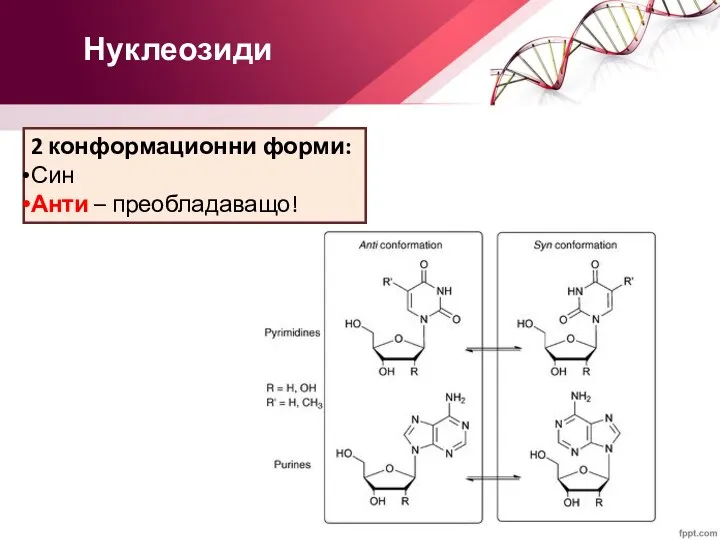
- 12. Нуклеозиди 2 конформационни форми: Син Анти – преобладаващо!
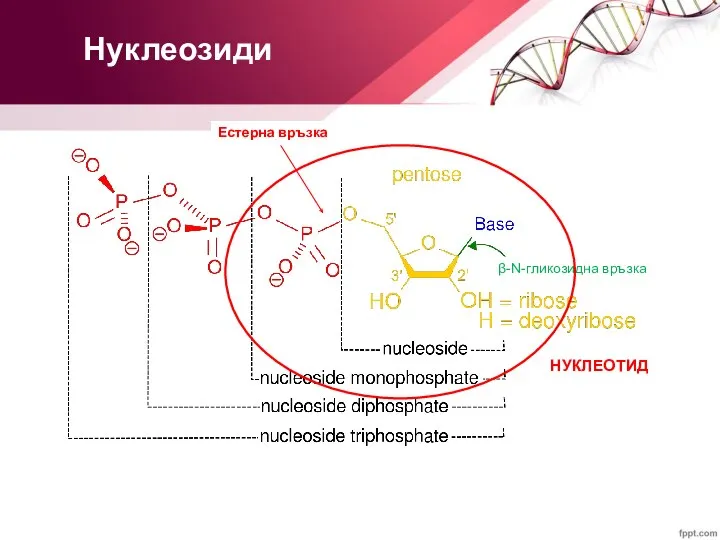
- 13. Нуклеозиди β-N-гликозидна връзка
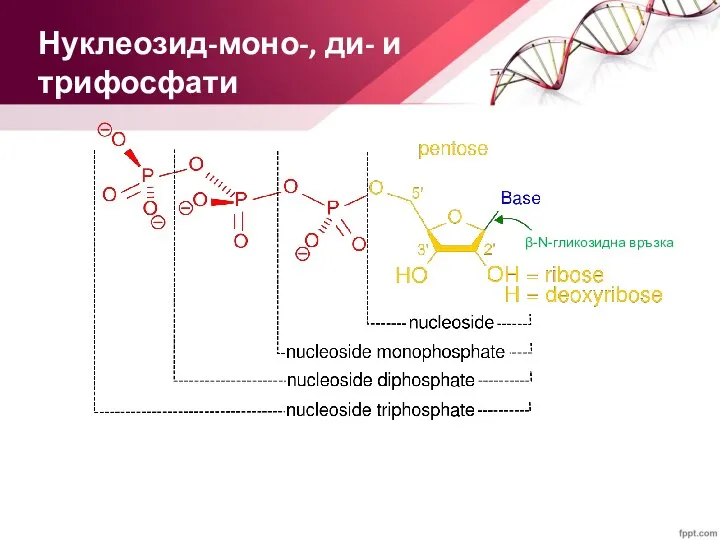
- 14. Нуклеозид-моно-, ди- и трифосфати β-N-гликозидна връзка
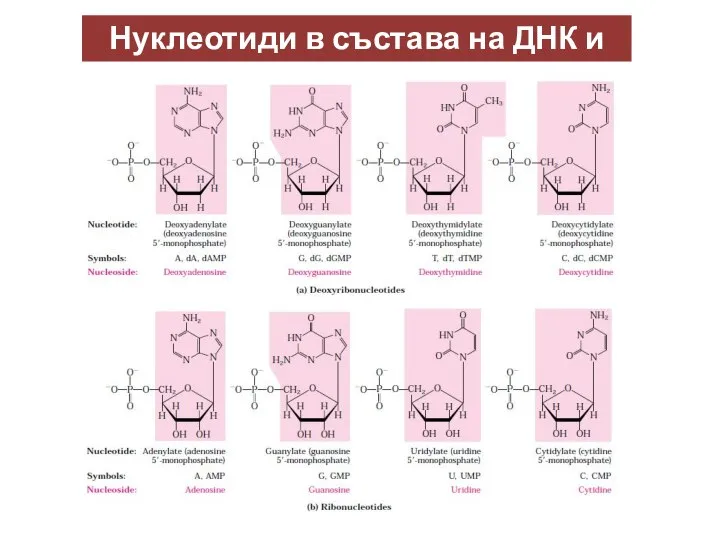
- 15. Нуклеотиди в състава на ДНК и РНК
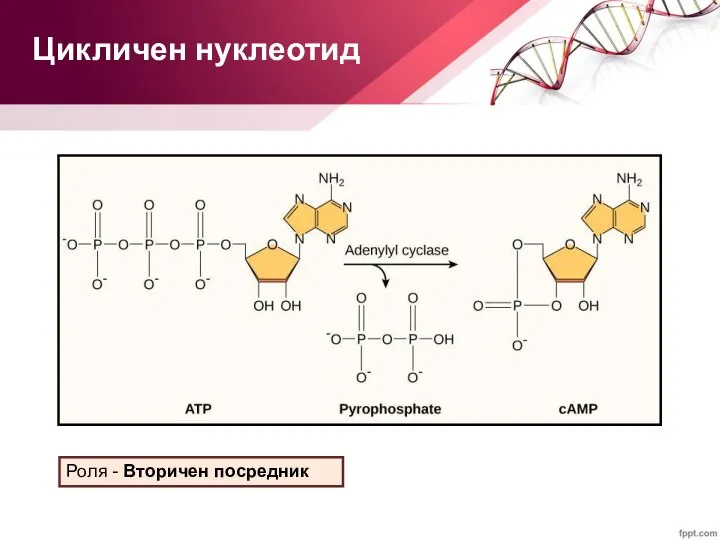
- 16. Цикличен нуклеотид Роля - Вторичен посредник
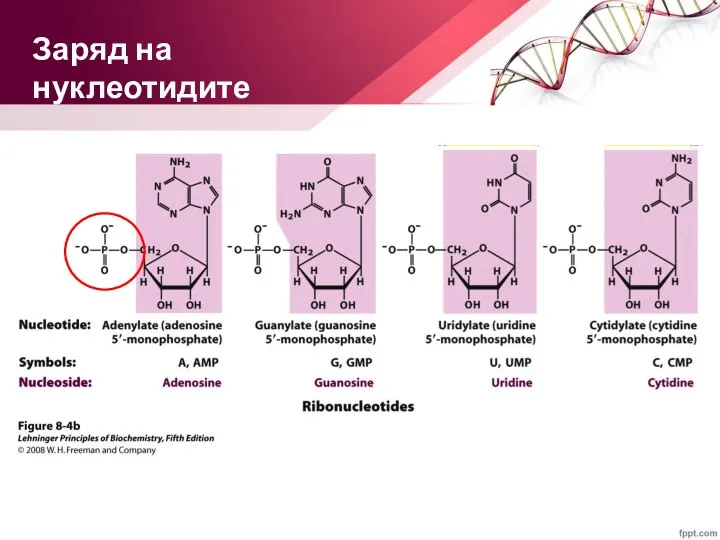
- 17. Заряд на нуклеотидите
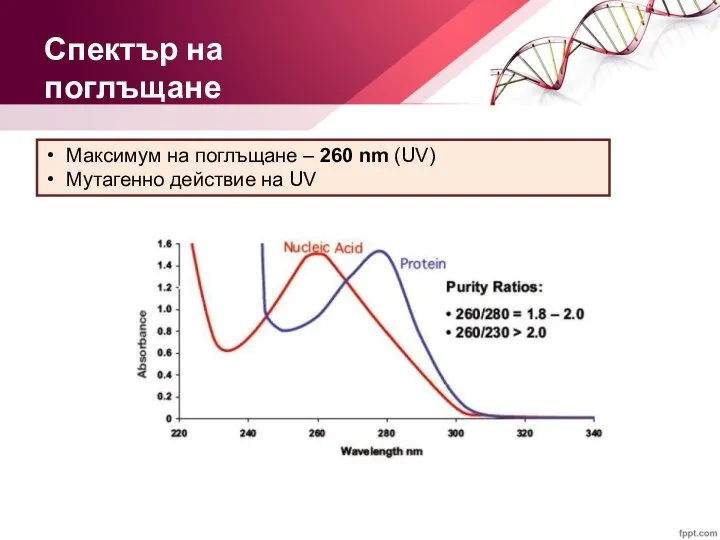
- 18. Максимум на поглъщане – 260 nm (UV) Мутагенно действие на UV Спектър на поглъщане
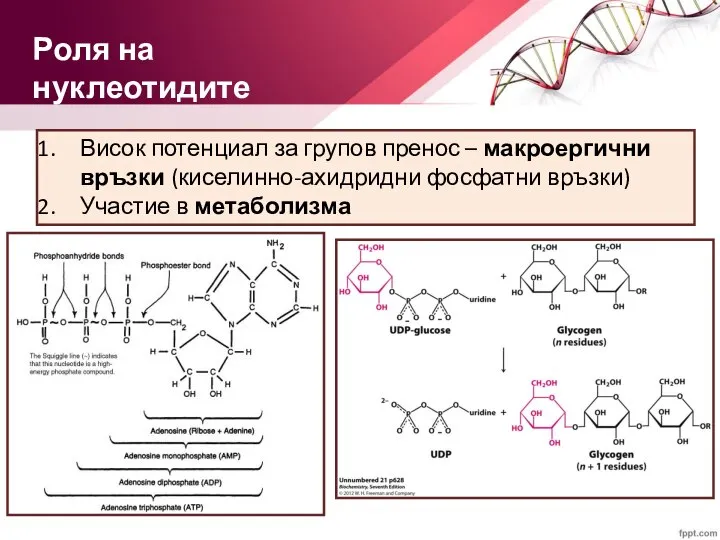
- 19. Висок потенциал за групов пренос – макроергични връзки (киселинно-ахидридни фосфатни връзки) Участие в метаболизма Роля на
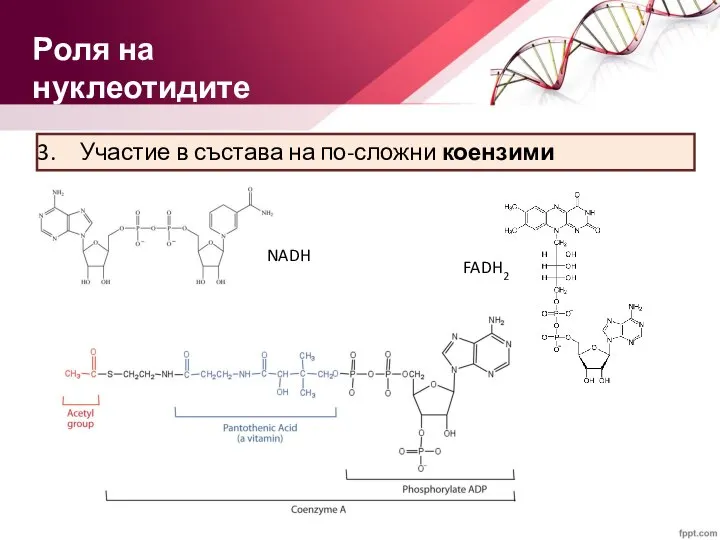
- 20. Участие в състава на по-сложни коензими Роля на нуклеотидите
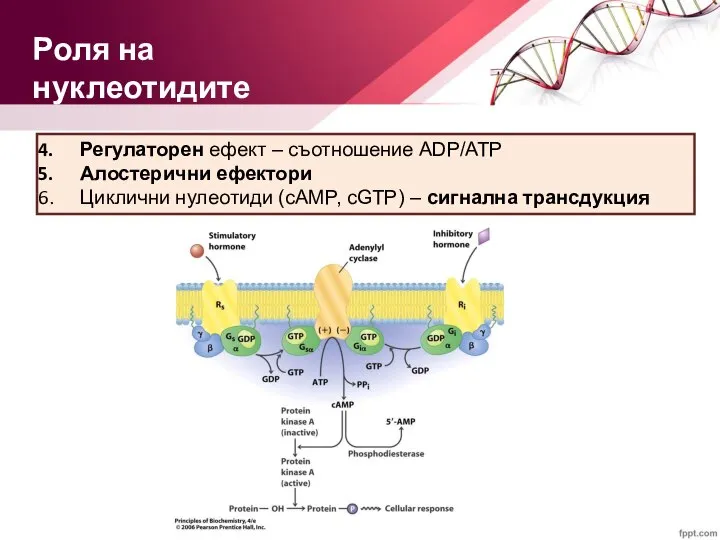
- 21. Регулаторен ефект – съотношение ADP/ATP Алостерични ефектори Циклични нулеотиди (cAMP, cGTP) – сигнална трансдукция Роля на
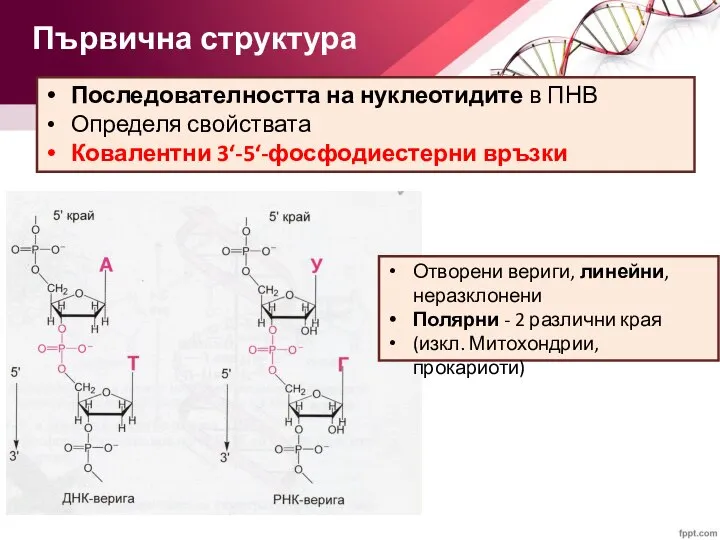
- 22. Последователността на нуклеотидите в ПНВ Определя свойствата Ковалентни 3‘-5‘-фосфодиестерни връзки Първична структура Отворени вериги, линейни, неразклонени
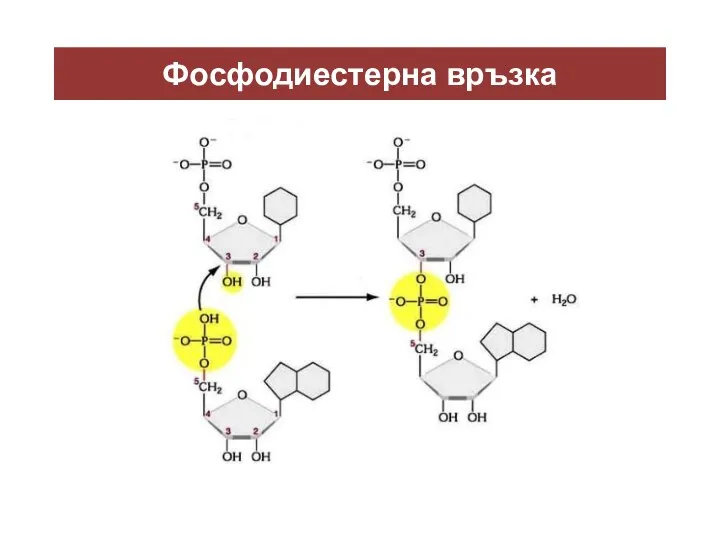
- 23. Фосфодиестерна връзка
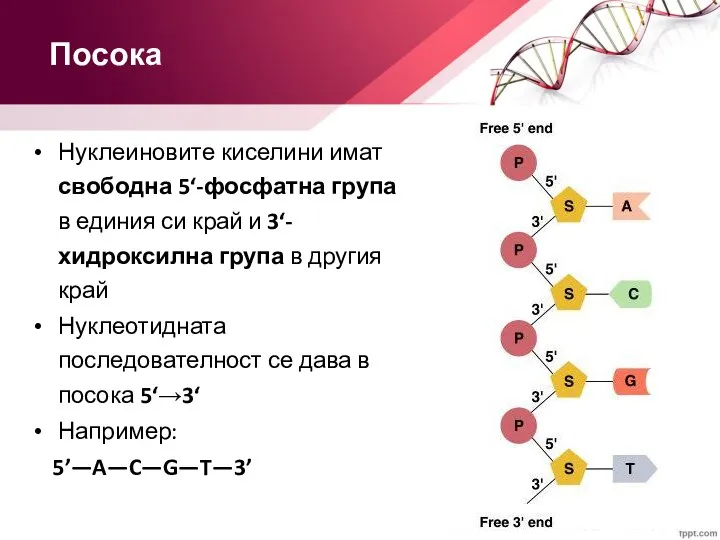
- 24. Нуклеиновите киселини имат свободна 5‘-фосфатна група в единия си край и 3‘-хидроксилна група в другия край
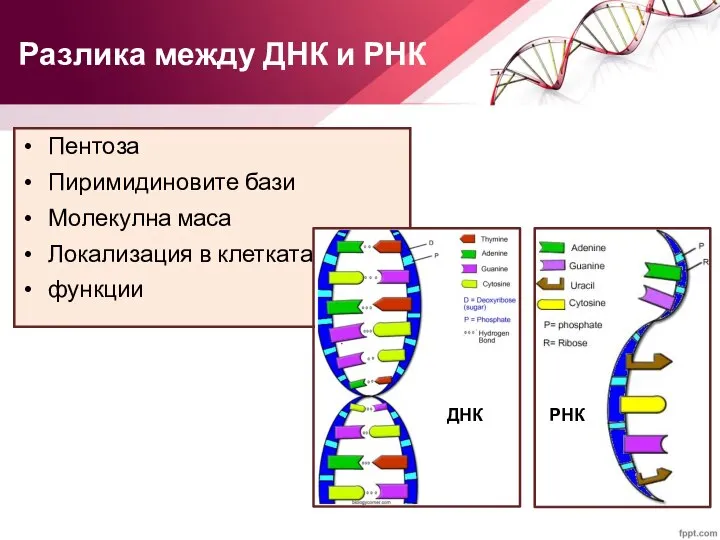
- 25. Пентоза Пиримидиновите бази Молекулна маса Локализация в клетката функции Разлика между ДНК и РНК ДНК РНК
- 26. ДНК Размери: E. coli 4x106bp човек – хаплоиден геном с 23 хромозоми – 3x109 bp Локализация:
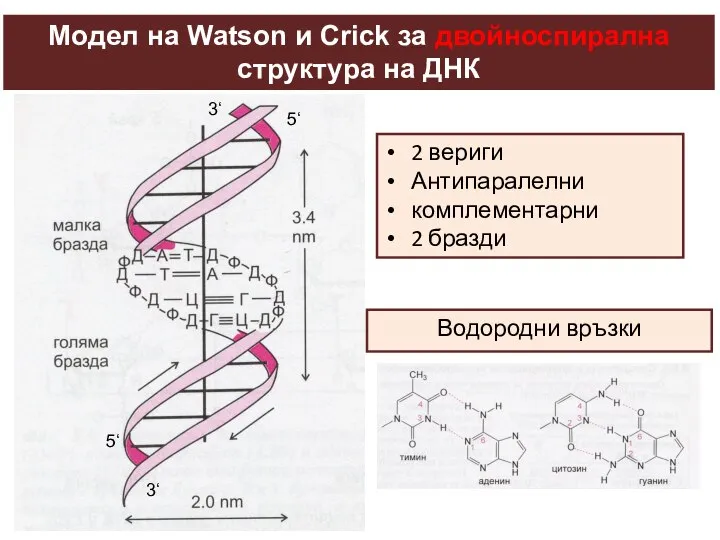
- 27. Модел на Watson и Crick за двойноспирална структура на ДНК 2 вериги Антипаралелни комплементарни 2 бразди
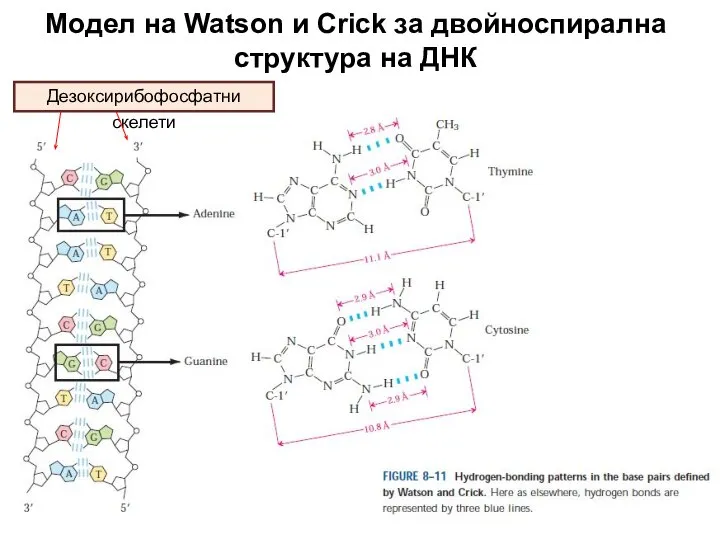
- 28. Модел на Watson и Crick за двойноспирална структура на ДНК Дезоксирибофосфатни скелети
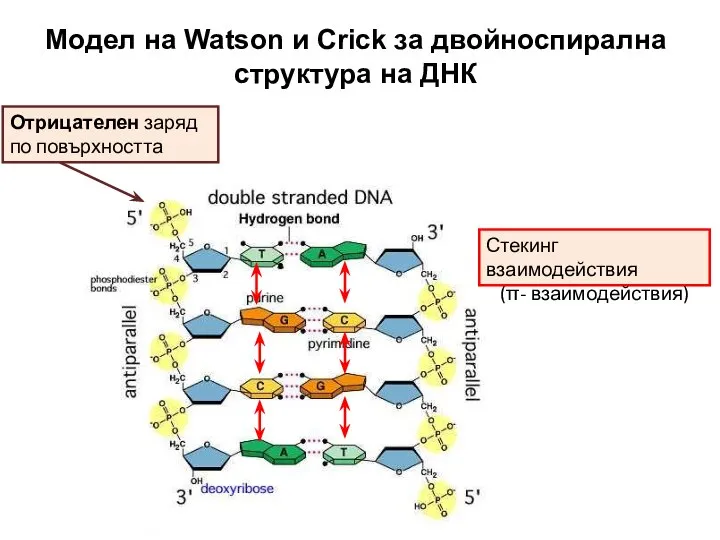
- 29. Модел на Watson и Crick за двойноспирална структура на ДНК
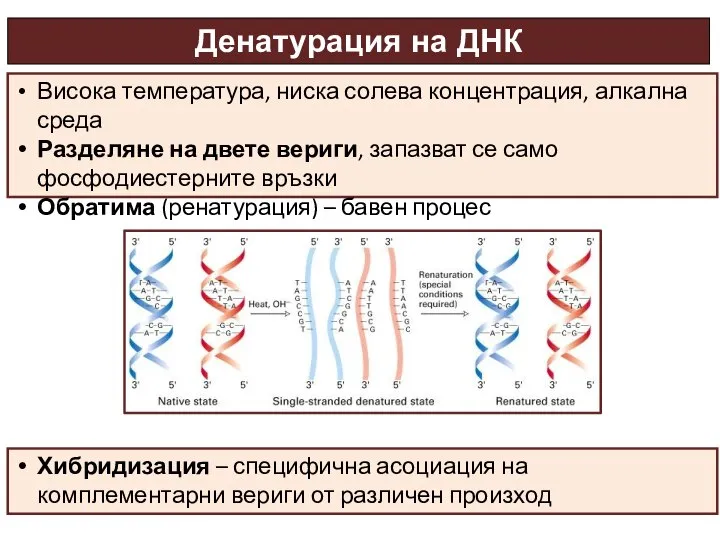
- 30. Денатурация на ДНК Висока температура, ниска солева концентрация, алкална среда Разделяне на двете вериги, запазват се
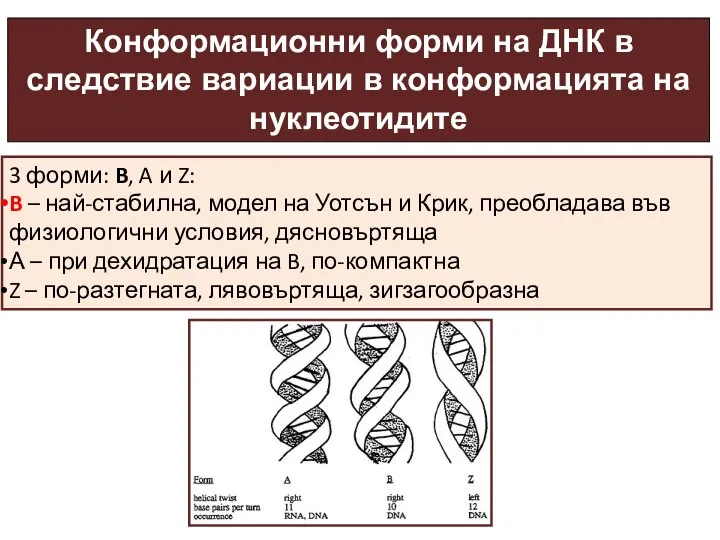
- 31. Конформационни форми на ДНК в следствие вариации в конформацията на нуклеотидите 3 форми: B, A и
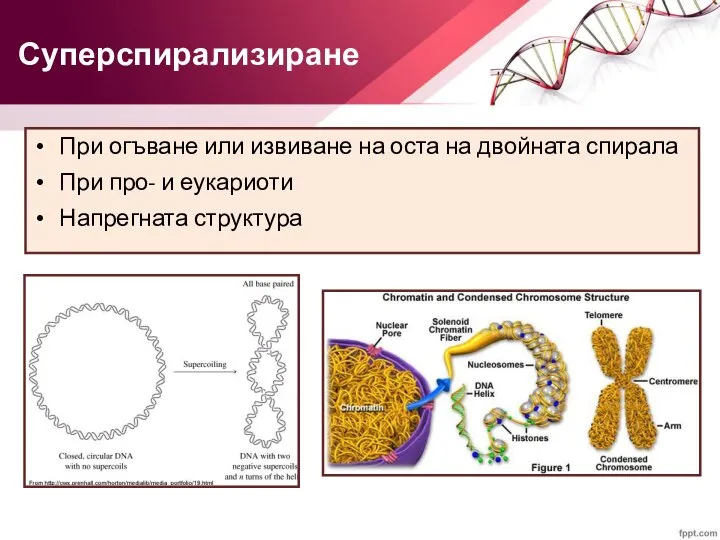
- 32. При огъване или извиване на оста на двойната спирала При про- и еукариоти Напрегната структура Суперспирализиране
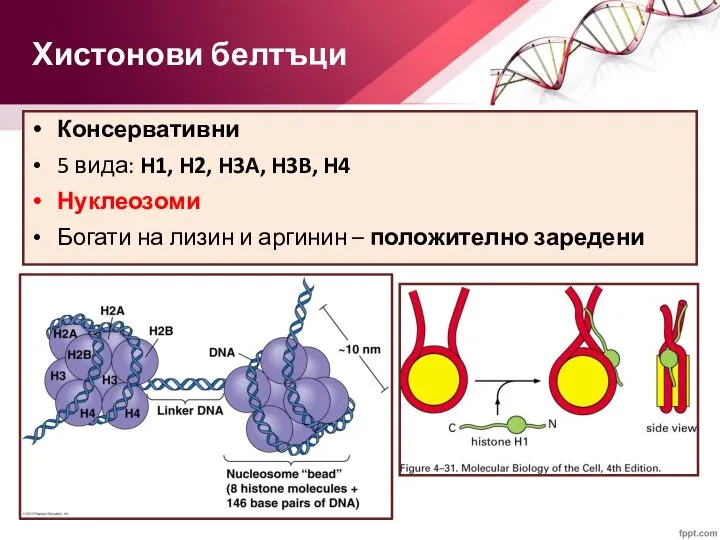
- 33. Консервативни 5 вида: H1, H2, H3A, H3B, H4 Нуклеозоми Богати на лизин и аргинин – положително
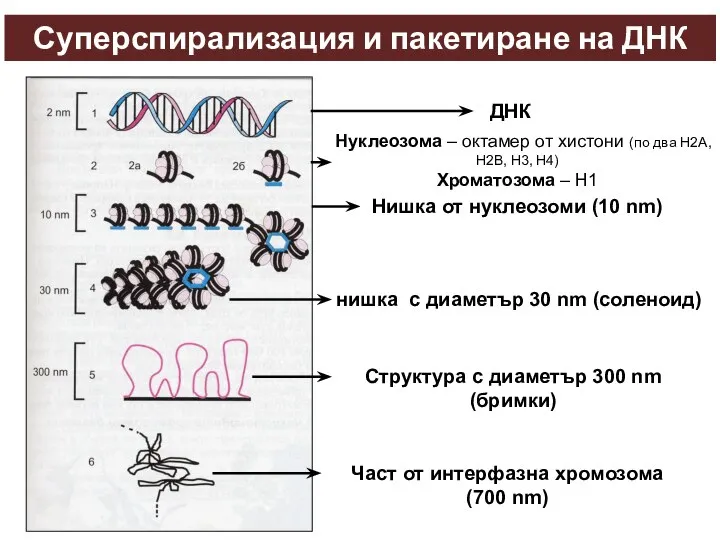
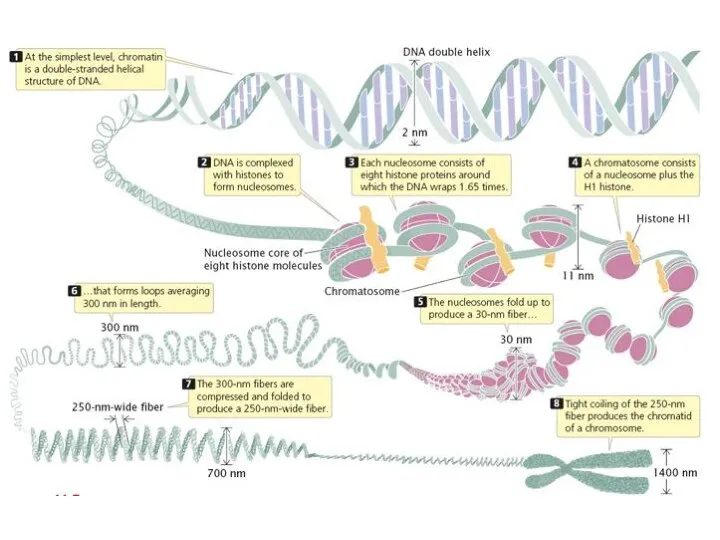
- 34. Суперспирализация и пакетиране на ДНК ДНК Нуклеозома – октамер от хистони (по два H2A, H2B, H3,
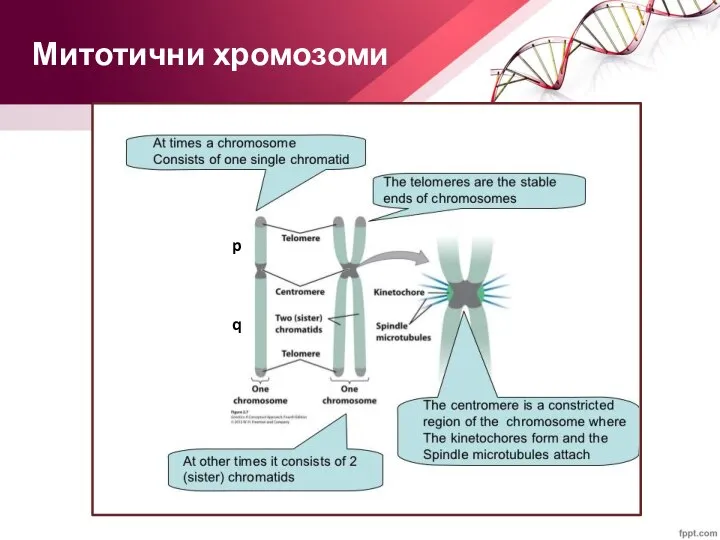
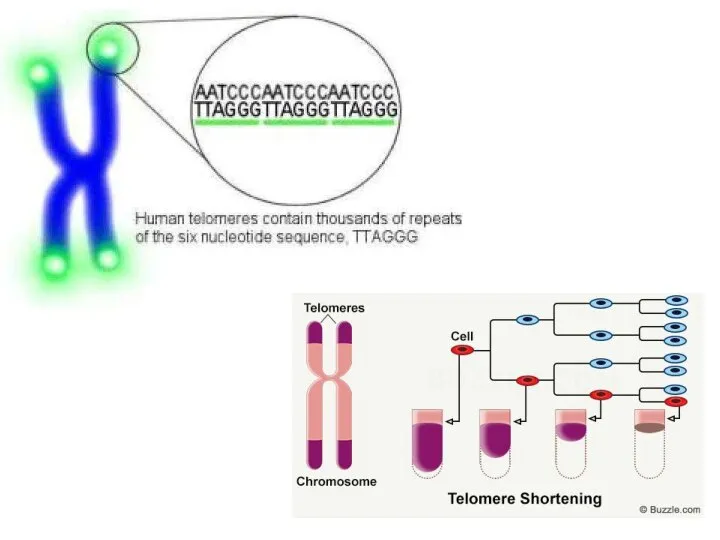
- 36. Митотични хромозоми p q
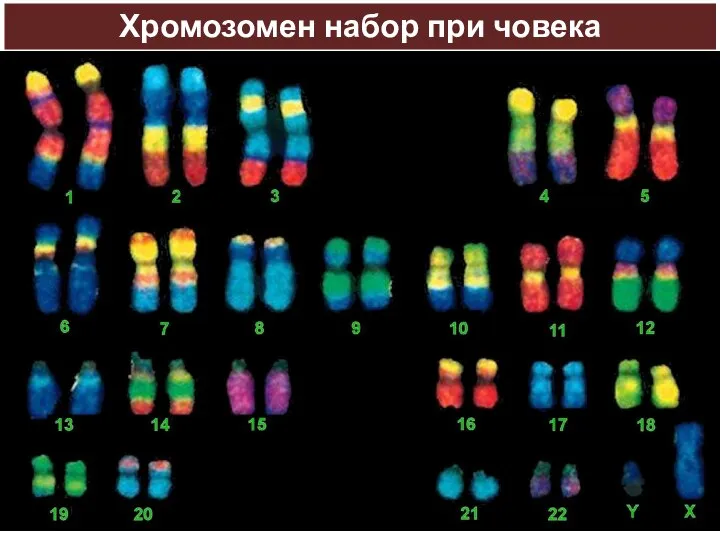
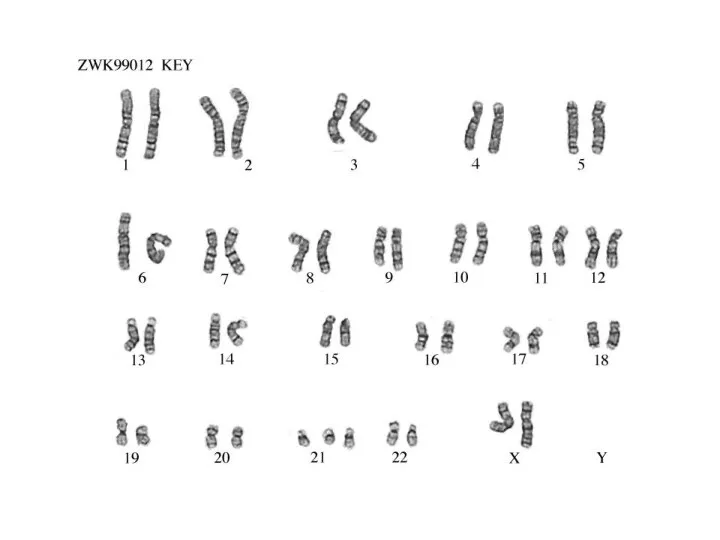
- 38. Хромозомен набор при човека
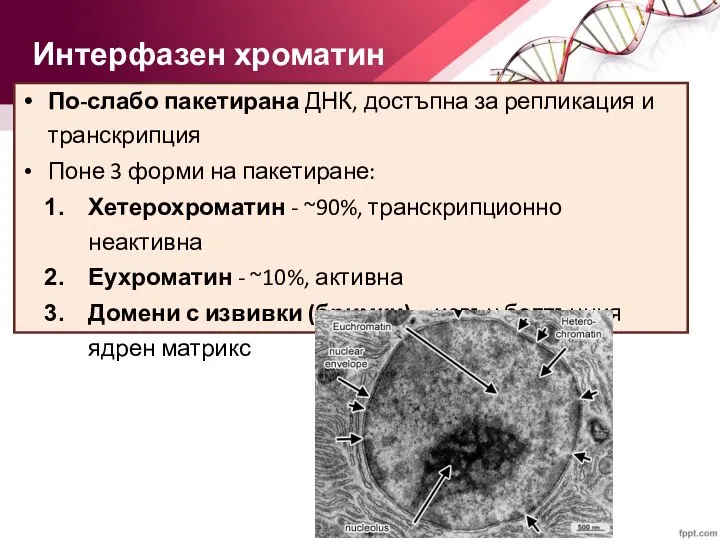
- 41. Интерфазен хроматин По-слабо пакетирана ДНК, достъпна за репликация и транскрипция Поне 3 форми на пакетиране: Хетерохроматин
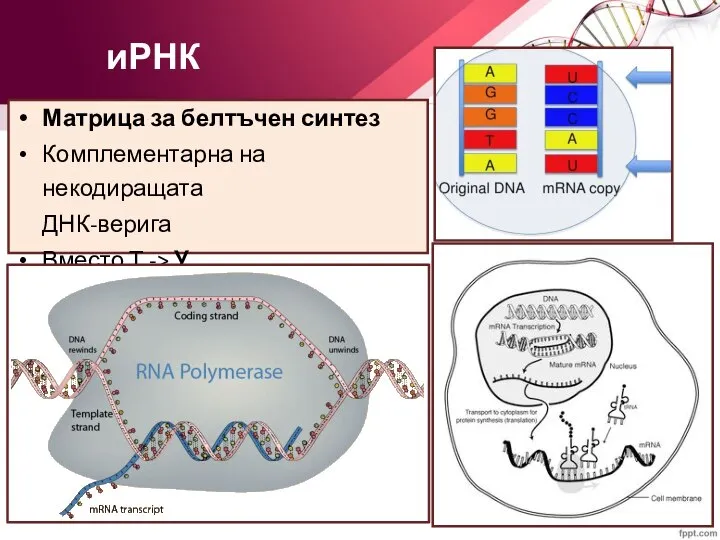
- 42. иРНК Матрица за белтъчен синтез Комплементарна на некодиращата ДНК-верига Вместо Т -> У
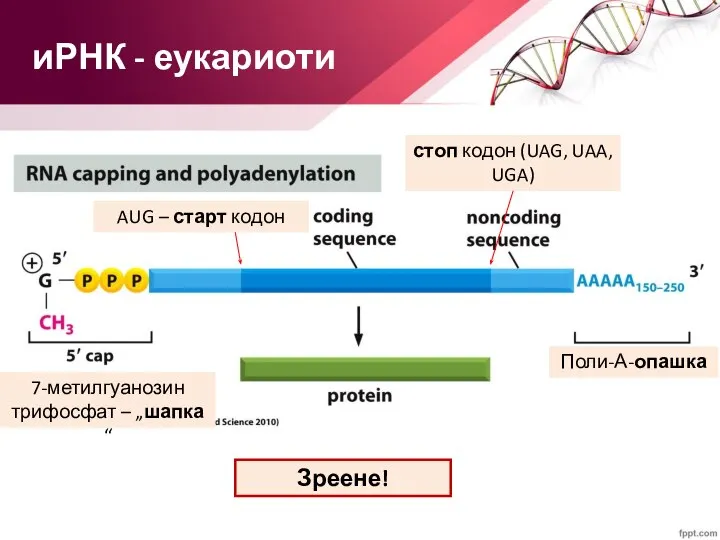
- 43. иРНК - еукариоти 7-метилгуанозин трифосфат – „шапка“ Поли-А-опашка Зреене!
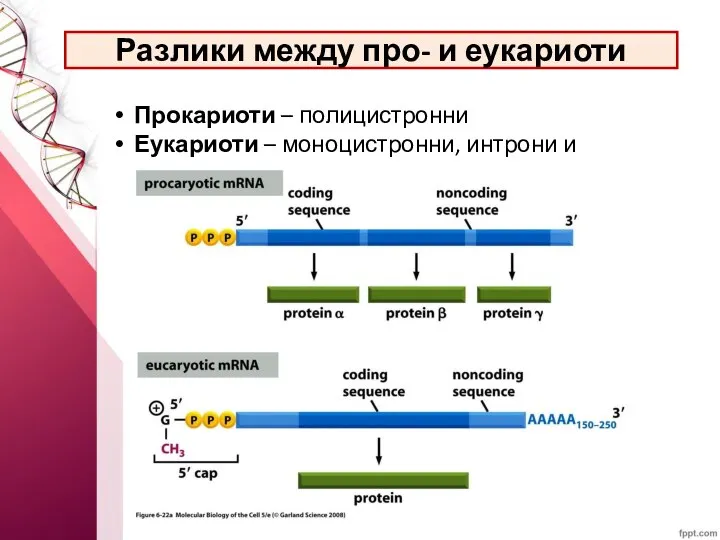
- 44. Разлики между про- и еукариоти Прокариоти – полицистронни Еукариоти – моноцистронни, интрони и екзони
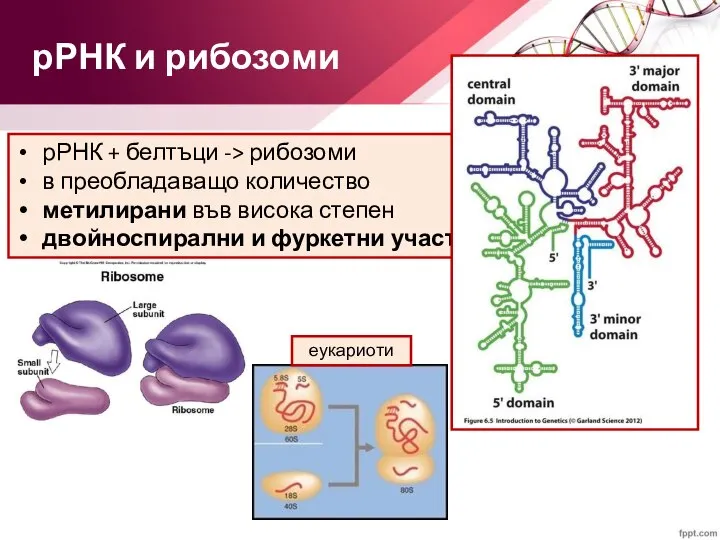
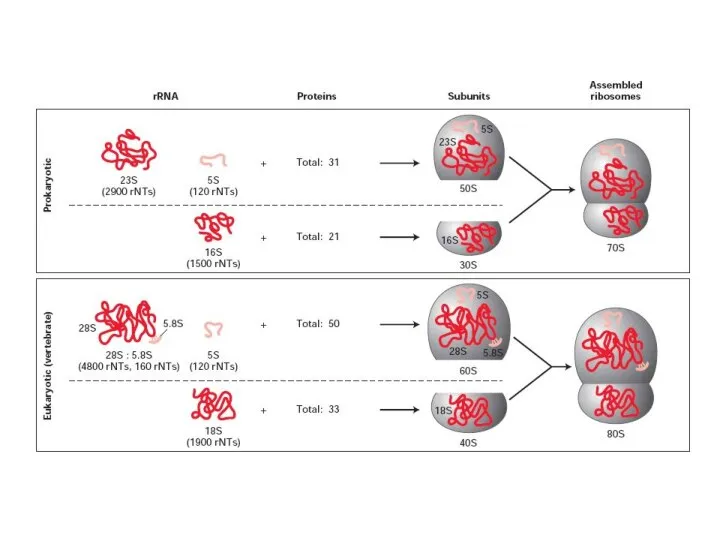
- 45. рРНК и рибозоми рРНК + белтъци -> рибозоми в преобладаващо количество метилирани във висока степен двойноспирални
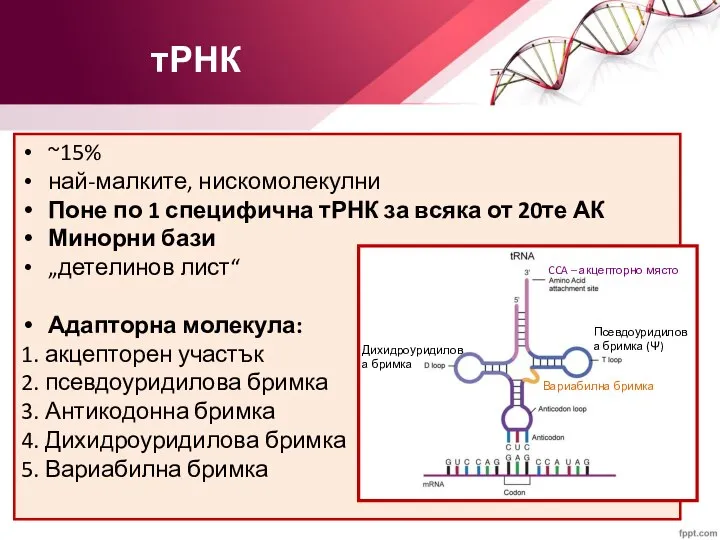
- 47. тРНК ~15% най-малките, нискомолекулни Поне по 1 специфична тРНК за всяка от 20те АК Минорни бази
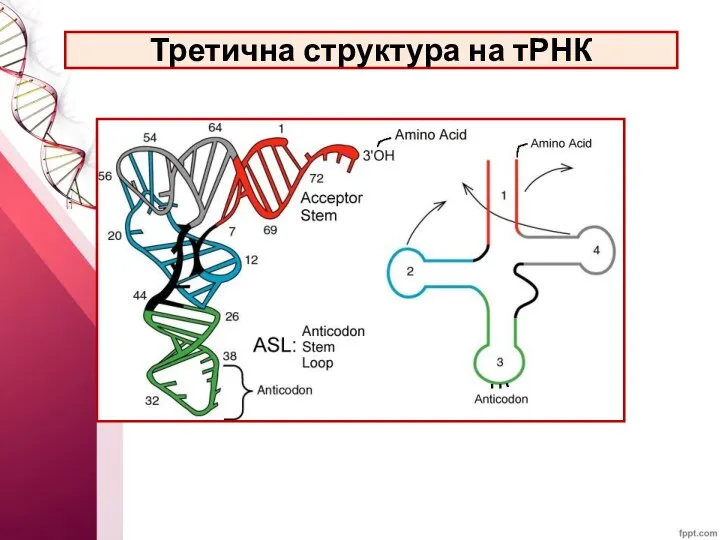
- 48. Третична структура на тРНК
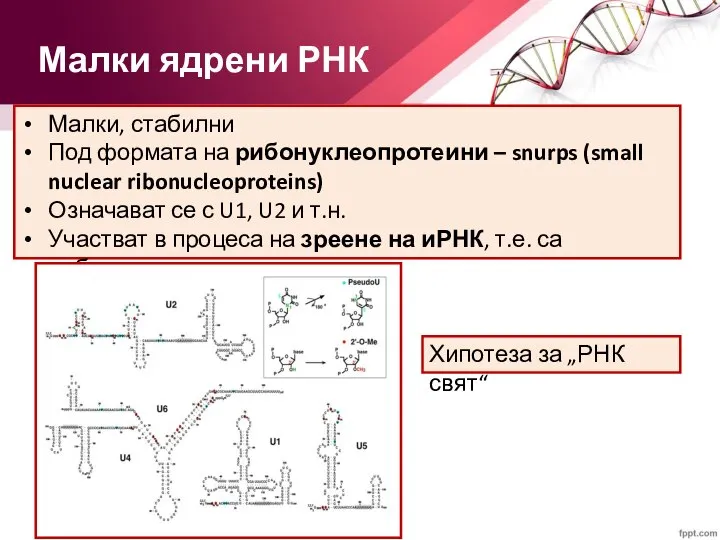
- 49. Малки ядрени РНК Малки, стабилни Под формата на рибонуклеопротеини – snurps (small nuclear ribonucleoproteins) Означават се
- 51. Скачать презентацию


 Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений Получение металлов
Получение металлов Каучук и резиновые материалы
Каучук и резиновые материалы Удивительное рядом
Удивительное рядом Ацилирование. Лекция 4
Ацилирование. Лекция 4 Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона Glin
Glin Наполнители для пластмасс
Наполнители для пластмасс Фенолы
Фенолы Вода… Химические названия
Вода… Химические названия Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация органических веществ
Классификация органических веществ Химия и география. Викторина
Химия и география. Викторина Metals Properties and compounds
Metals Properties and compounds Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Химико-металлургические методы
Химико-металлургические методы Атомы. Нахождение в природе
Атомы. Нахождение в природе Теоретические основы процессов получения и переработки полимерных материалов
Теоретические основы процессов получения и переработки полимерных материалов Устный журнал из истории развития химии
Устный журнал из истории развития химии Опасная бытовая химия!
Опасная бытовая химия! способы разделения смесей
способы разделения смесей Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Физико-химические основы получения лекарственных препаратов
Физико-химические основы получения лекарственных препаратов валентность (1)
валентность (1) Исследование коррозии и создание антикоррозийного состава
Исследование коррозии и создание антикоррозийного состава Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие