Содержание
Слайд 24. Серебристо-белый металл А сгорает на воздухе с образованием желтоватого соединения Б, содержащего
4. Серебристо-белый металл А сгорает на воздухе с образованием желтоватого соединения Б, содержащего

а) Определите неизвестные вещества А – Ж и запишите уравнения всех реакций. Состав соединений Б и Ж подтвердите расчётом.
б) Перечислите продукты сгорания в сухом воздухе металлов 2-6 периодов той группы, к которой принадлежит А.
Варианты 2 и 6
Rb+O2=RbO2
4RbO2+2H2O=4RbOH+3O2
2RbO2+CO2=Rb2CO3+1.5O2
2RbOH+H2SO4=Rb2SO4
Rb2SO4+Al2(SO4)3+24H2O=2RbAl(SO4)2*12H2O
Баллы:
5 баллов за 5 реакций + 1 балл за продукты сгорания
Типичная ошибка – не указывать Li3N в продуктах сгорания лития -0.5б
6Li+3N2=2Li3N
4Li+O2=2Li2O
2Na+O2=Na2O2
M+O2=MO2 (K, Rb, Cs)
Слайд 34. Серебристо-белый тяжелый металл А растворяется в 20% серной кислоте с выделением газа
4. Серебристо-белый тяжелый металл А растворяется в 20% серной кислоте с выделением газа

а) Определите неизвестные вещества А – З и запишите все уравнения реакций. Состав соединений В и З подтвердите расчётом.
б) Качественно охарактеризуйте окислительные свойства оксидов элементов в высшей степени окисления той группы, к которой принадлежит металл А.
Варианты 3 и 7
2M+nH2SO4=M2(SO4)n+H2
M2(SO4)n+nBa(OH)2=nBaSO4+2M(OH)n
M(OH)n+nHCl=MCln+nH2O
M(OH)n+Cl2+KOH=???
M(OH)n+Be(OH)2=???
Баллы:
5 баллов за 5 реакций + 1 балл за сравнение свойств
Типичная ошибка – Pb2+ вместо Tl+
2Tl+H2SO4=Tl2SO4+H2
Tl2SO4+Ba(OH)2=BaSO4+2TlOHn
TlOH+HCl=TlCl+H2O
2TlOH+2Cl2+4KOH=Tl2O3+4KCl+3H2O
2TlOH+Be(OH)2=Tl2[Be(OH)4]
Для B И Al окислительные свойства вовсе не характерны.
Галлий и индий могут быть восстановлены из оксидов сильными восстановителями:
Ga2O3+3H2=2Ga+3H2O (при нагревании)
Оксид таллия - очень сильный окислитель вследствие инертности 6s2 пары:
Tl2O3+6HCl=2TlCl+2Cl2+3H2O
 Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1
Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1 Budowa pasmowa ciał stałych
Budowa pasmowa ciał stałych 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala Интересное о кристаллизации
Интересное о кристаллизации Арены. Бензол
Арены. Бензол Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Химическая связь и строение молекул
Химическая связь и строение молекул Типы химических реакций
Типы химических реакций Кристаллография
Кристаллография Презентация на тему Волокна
Презентация на тему Волокна  Медиатехнологии на уроках химии
Медиатехнологии на уроках химии Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Относительная атомная масса. Массы атомов
Относительная атомная масса. Массы атомов Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Азот
Азот Цветные реакции белков
Цветные реакции белков Полимеры
Полимеры Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений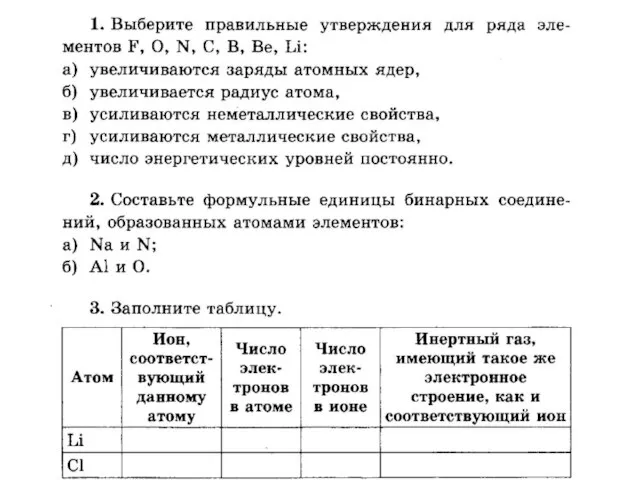 Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Презентация на тему Спирты
Презентация на тему Спирты  Основы радиохимии и радиологии
Основы радиохимии и радиологии Ионные уравнения
Ионные уравнения Исследование биодеградации полимерных материалов методом АСМ
Исследование биодеградации полимерных материалов методом АСМ Как определять минералы
Как определять минералы Салициловая кислота
Салициловая кислота Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение)