Слайд 2Положение пиридазина.
Диазины формально можно рассматривать как гетероциклические соединения, образующиеся из бензола или
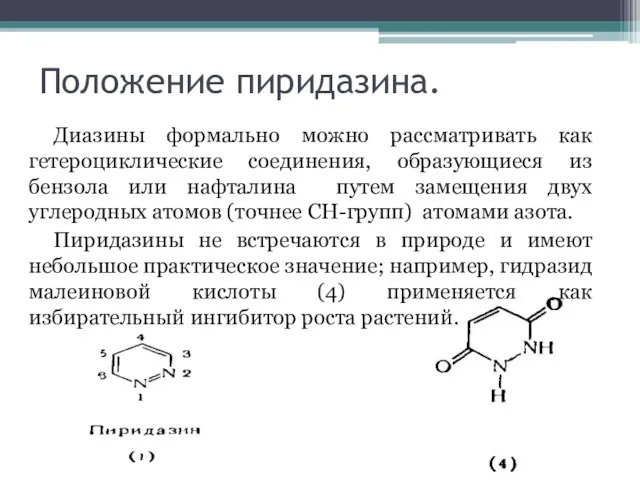
нафталина путем замещения двух углеродных атомов (точнее СН-групп) атомами азота.
Пиридазины не встречаются в природе и имеют небольшое практическое значение; например, гидразид малеиновой кислоты (4) применяется как избирательный ингибитор роста растений.
Слайд 3Методы синтеза пиридазинов.
Большая часть синтезов пиридазинового кольца основана на присоединении гидразина и

его производных к углеродной цепочке с соответствующими заместителями в положениях 1,4.
Конденсация производных гидразина с 1,4-диацилэтиленами, производными малеинового ангидрида, 4-альдегидо или 4-кетокислотами, бутенолидами, 2-бром или 2-гидрокси-1,4-дикарбонильными соединениями, а также производными дигидрофурана приводят к образованию пиридазиновых колец.
Слайд 4Синтез с малеиновым ангидридом.
Главное преимущество синтезов малеиновым ангидридом или 1,4-диацетиленами состоит в
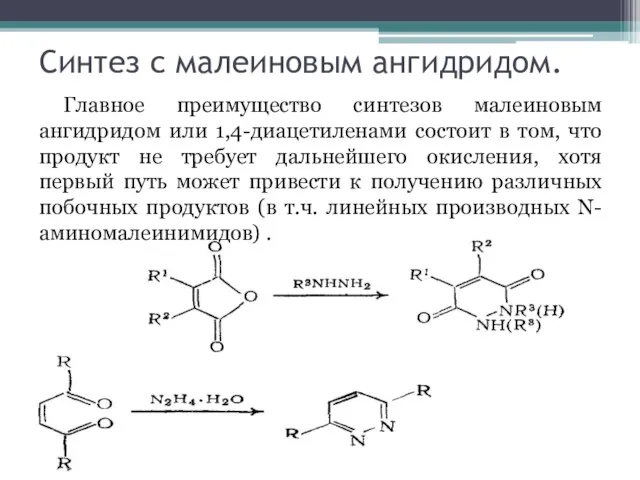
том, что продукт не требует дальнейшего окисления, хотя первый путь может привести к получению различных побочных продуктов (в т.ч. линейных производных N-аминомалеинимидов) .
Слайд 5Синтез из 1,4-дкетонов.
1,4-Дикетоны реагируют с гидразином и его производными, образуя 1,4- или
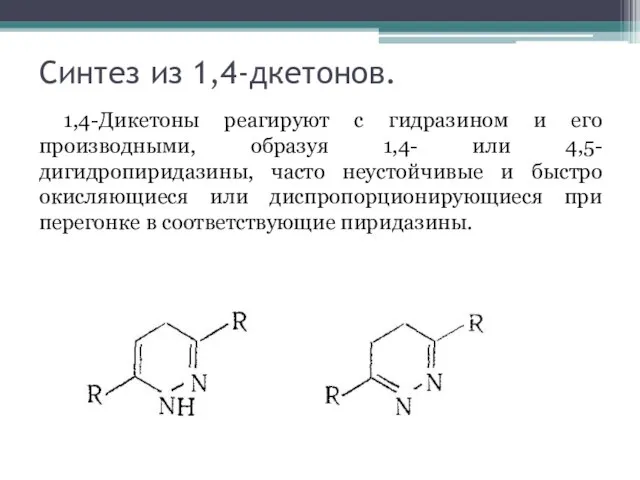
4,5-дигидропиридазины, часто неустойчивые и быстро окисляющиеся или диспропорционирующиеся при перегонке в соответствующие пиридазины.
Слайд 6Получение из кето- и альдегидокислот.
1,4-Кето или -альдегидокислоты также легко конденсируются с гидразином
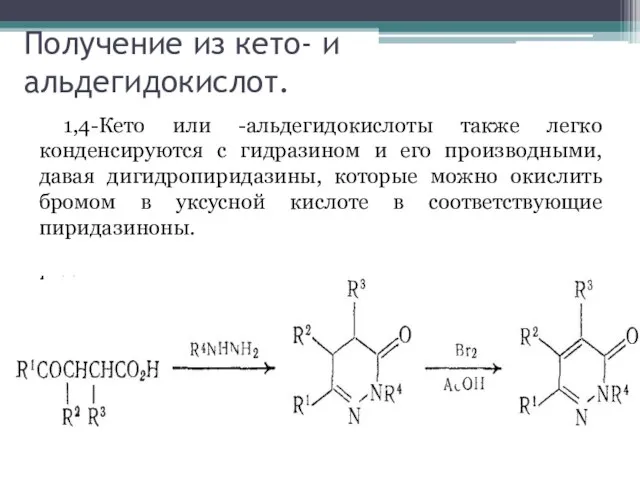
и его производными, давая дигидропиридазины, которые можно окислить бромом в уксусной кислоте в соответствующие пиридазиноны.
Слайд 7Удобным методом синтеза 3(2H)-пиридазинонов служит реакция α-дикетонов с производными гидразина в присутствии
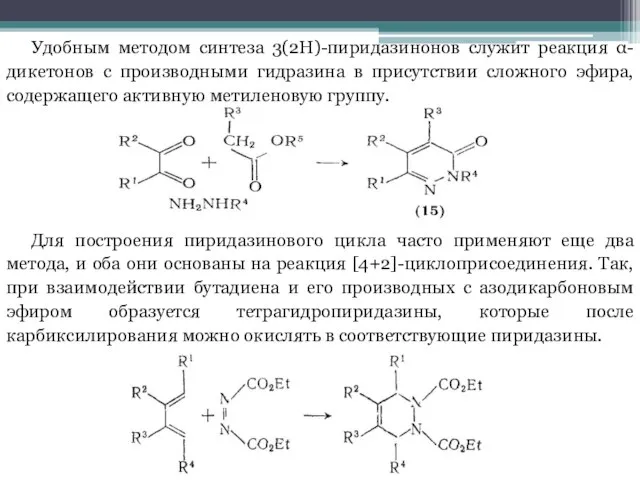
сложного эфира, содержащего активную метиленовую группу.
Для построения пиридазинового цикла часто применяют еще два метода, и оба они основаны на реакция [4+2]-циклоприсоединения. Так, при взаимодействии бутадиена и его производных с азодикарбоновым эфиром образуется тетрагидропиридазины, которые после карбиксилирования можно окислять в соответствующие пиридазины.
Слайд 8Другой вариант-это реакции циклоприсоединения тетразинов к ацетиленам или олефинам, что соответственно приводит
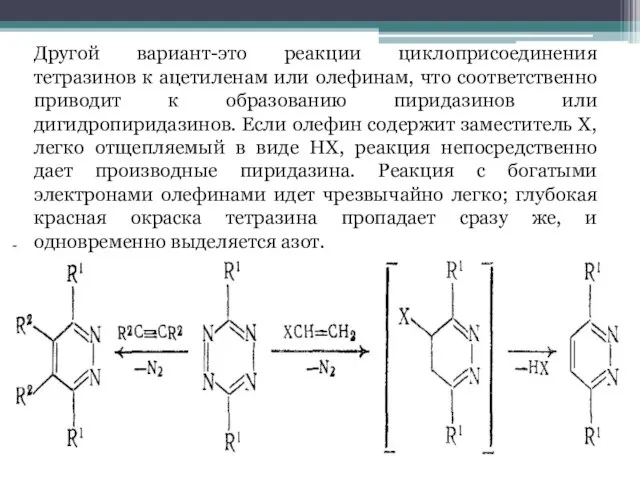
к образованию пиридазинов или дигидропиридазинов. Если олефин содержит заместитель X, легко отщепляемый в виде HX, реакция непосредственно дает производные пиридазина. Реакция с богатыми электронами олефинами идет чрезвычайно легко; глубокая красная окраска тетразина пропадает сразу же, и одновременно выделяется азот.
Слайд 9Химические свойства пиридазинов.
Пиридазин является более слабым основанием (pKB=2,33), чем пиридин (pKB=5,23), вследствие электроноакцепторного влияния

второго атома азота. Обычно протонируется только один атом азота молекулы пиридазина, второй атом азота может протонироваться только в концентрированных растворах кислот.
В реакции электрофильного замещения пиридазин вступает с большим трудом, в реакции нитрования, сульфирования, галогенирования и ацилирования практически не вступает. С алкилгалогенидами образует соответствующие N-соли.
В большинстве случаев нуклеофильного замещения диазинов входящая группа вытесняет не водород, а какой-либо из заместителей кольца, чаще всего атом галогена. Это объясняется доступностью галогендиазинов из соответствующих оксодиазинов, которые с в свою очередь легко получить прямым синтезом. Реакционная способность атомов галогена, связанных с кольцом диазина, в значительной степени зависит от природы галогена, положения в кольце, о нуклеофила и вляния других заместителей.
Слайд 10Атомы галогена в дигалогензамещенных диазинах, как правило сильно различаются по подвижности, и
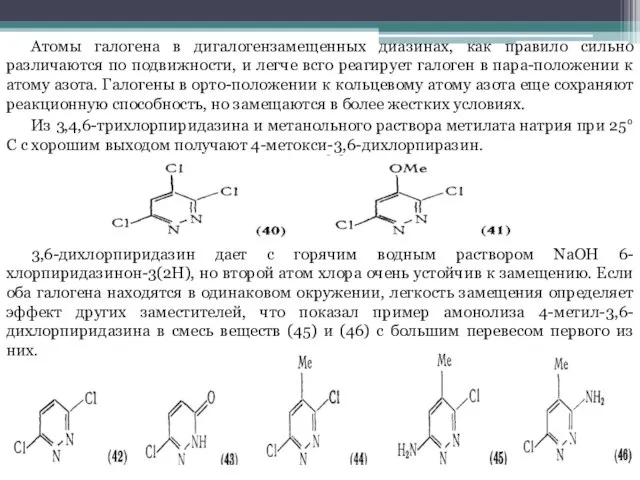
легче всго реагирует галоген в пара-положении к атому азота. Галогены в орто-положении к кольцевому атому азота еще сохраняют реакционную способность, но замещаются в более жестких условиях.
Из 3,4,6-трихлорпиридазина и метанольного раствора метилата натрия при 25°С с хорошим выходом получают 4-метокси-3,6-дихлорпиразин.
3,6-дихлорпиридазин дает с горячим водным раствором NaOH 6-хлорпиридазинон-3(2H), но второй атом хлора очень устойчив к замещению. Если оба галогена находятся в одинаковом окружении, легкость замещения определяет эффект других заместителей, что показал пример амонолиза 4-метил-3,6-дихлорпиридазина в смесь веществ (45) и (46) с большим перевесом первого из них.
Слайд 11Гомолитическое ароматическое замещение диазинов встречается редко, и сведений об относительной реакционной способности
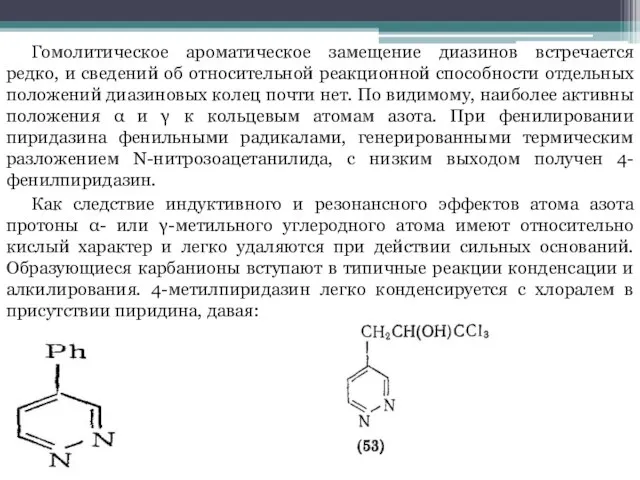
отдельных положений диазиновых колец почти нет. По видимому, наиболее активны положения α и γ к кольцевым атомам азота. При фенилировании пиридазина фенильными радикалами, генерированными термическим разложением N-нитрозоацетанилида, с низким выходом получен 4-фенилпиридазин.
Как следствие индуктивного и резонансного эффектов атома азота протоны α- или γ-метильного углеродного атома имеют относительно кислый характер и легко удаляются при действии сильных оснований. Образующиеся карбанионы вступают в типичные реакции конденсации и алкилирования. 4-метилпиридазин легко конденсируется с хлоралем в присутствии пиридина, давая:










 Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Характеристика высших гидроксидов по положению в ПСХЭ
Характеристика высших гидроксидов по положению в ПСХЭ Термохимические эффекты реакций
Термохимические эффекты реакций Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Витамины и их роль в жизни людей
Витамины и их роль в жизни людей Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Амины
Амины Многоатомные спирты
Многоатомные спирты Агрегатные состояния веществ
Агрегатные состояния веществ Углеводороды. Характеристика
Углеводороды. Характеристика Алкены
Алкены Номенклатура алкенов. Теория
Номенклатура алкенов. Теория Энергетика хим процессов
Энергетика хим процессов Презентация на тему Интерактивная игра "Химический лабиринт"
Презентация на тему Интерактивная игра "Химический лабиринт"  Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Полимеры. Виды полимеров
Полимеры. Виды полимеров Природные источники углеводородов
Природные источники углеводородов Составление ионных уравнений
Составление ионных уравнений Оксид серы (VI) SO3
Оксид серы (VI) SO3 Презентация на тему Аминокислоты. История их открытия
Презентация на тему Аминокислоты. История их открытия  Применение алкенов
Применение алкенов Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов
Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов Минеральные воды Старой Руссы
Минеральные воды Старой Руссы Что такое бинарные соединения?
Что такое бинарные соединения? Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb) Задачи. Периодическая система. Строение атома. Повторение
Задачи. Периодическая система. Строение атома. Повторение Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела
Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела