Содержание
- 2. Определите степени окисления элементов в соединениях и дайте названия веществам 1 вариант Na2S, Na3N, NaH, MgCl2,
- 3. Составьте формулы веществ Сульфид лития Хлорид кальция Оксид хрома (VI) Оксид углерода (IV) Силицид магния Фторид
- 4. Решите задачу 1 вариант Вычислите объем, который займут 88 мг оксида углерода (IV) (н.у.). Сколько атомов
- 5. Основания – Me +n(OH)-n Это сложные вещества, состоящие из ионов металлов и связанных с ними одного
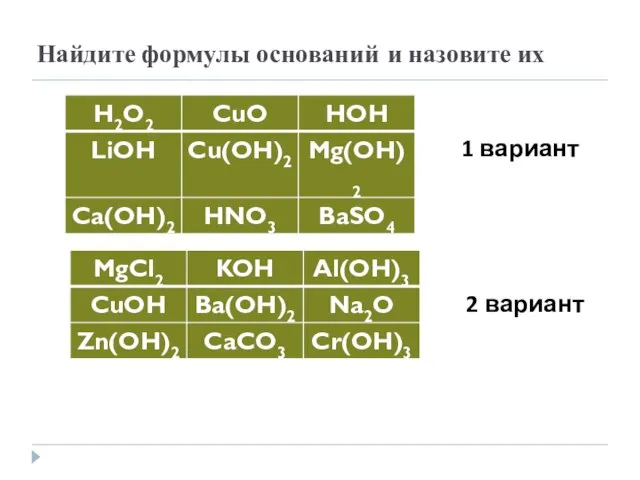
- 6. Найдите формулы оснований и назовите их 1 вариант 2 вариант
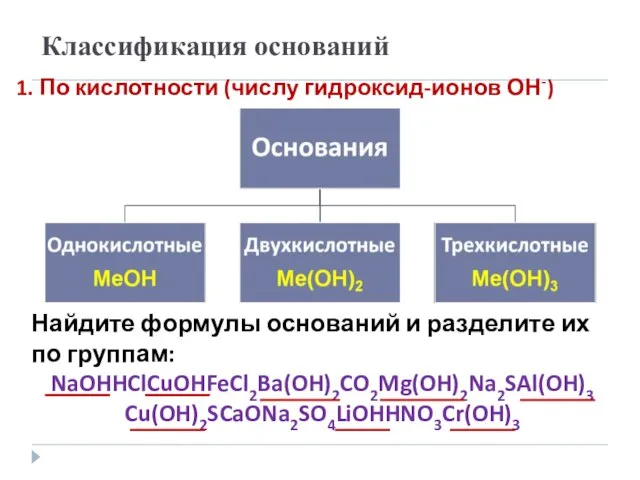
- 7. Классификация оснований 1. По кислотности (числу гидроксид-ионов ОН-) Найдите формулы оснований и разделите их по группам:
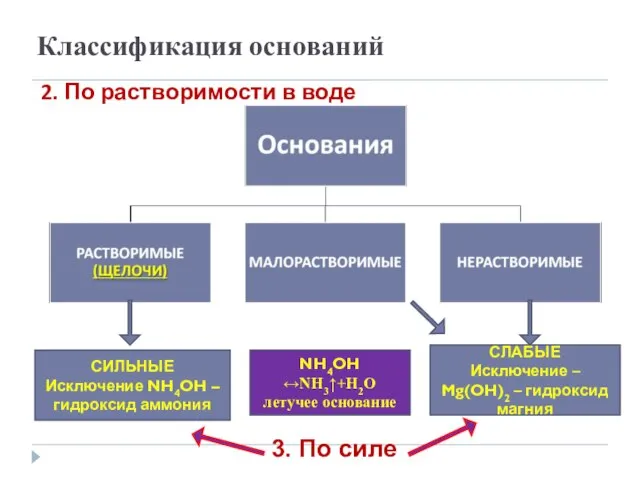
- 8. Классификация оснований 2. По растворимости в воде СЛАБЫЕ Исключение – Mg(OH)2 – гидроксид магния СИЛЬНЫЕ Исключение
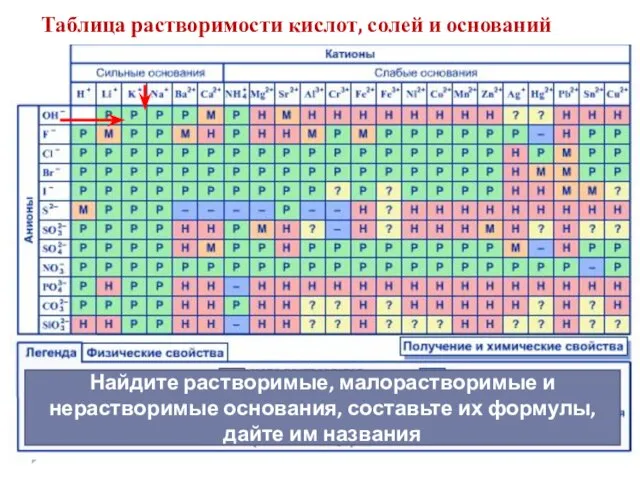
- 9. Таблица растворимости кислот, солей и оснований Найдите растворимые, малорастворимые и нерастворимые основания, составьте их формулы, дайте
- 10. Качественные реакции Реакции, с помощью которых распознают определенные вещества Как можно определить основания? Щелочи – определяют
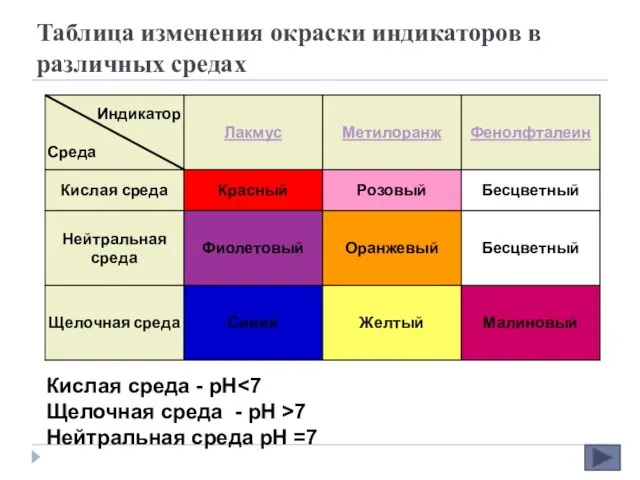
- 11. Таблица изменения окраски индикаторов в различных средах Кислая среда - рН Щелочная среда - рН >7
- 12. Лакмус Красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов В кислых
- 13. Мнемоническое правило Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение: Индикатор лакмус —
- 14. Метиловый оранжевый является органическим синтетическим красителем из группы азокрасителей в кислой среде красный, в щелочной —
- 15. Мнемоническое правило Для запоминания цвета индикатора метилового оранжевого в щелочах и кислотах служит стихотворение: От щелочи
- 16. Фенолфталеин Трифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску от бесцветной (при pHТрифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску
- 17. Мнемонические правила Для запоминания цвета фенолфталеина в щелочной среде (в случае его применения в качестве индикатора)
- 18. Качественное определение веществ Известковая вода – качественный реагент на углекислый газ Гидрокси́д ка́льция ( Ca(OH)2 ,
- 19. Известковая вода Прозрачный раствор гидроксида кальция. Она используется для обнаружения углекислого газа. При взаимодействии с ним
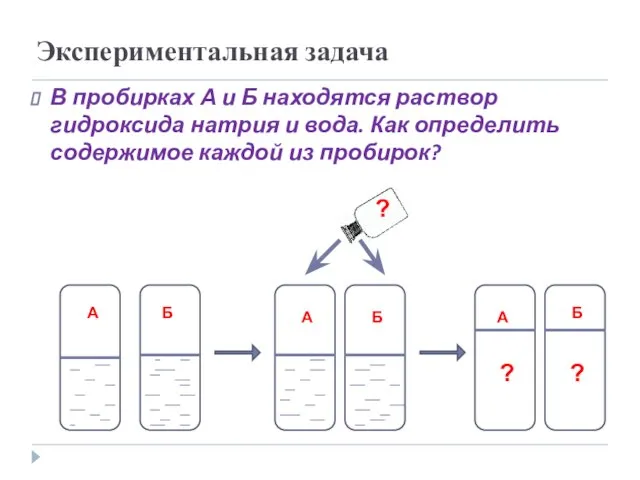
- 20. Экспериментальная задача В пробирках А и Б находятся раствор гидроксида натрия и вода. Как определить содержимое
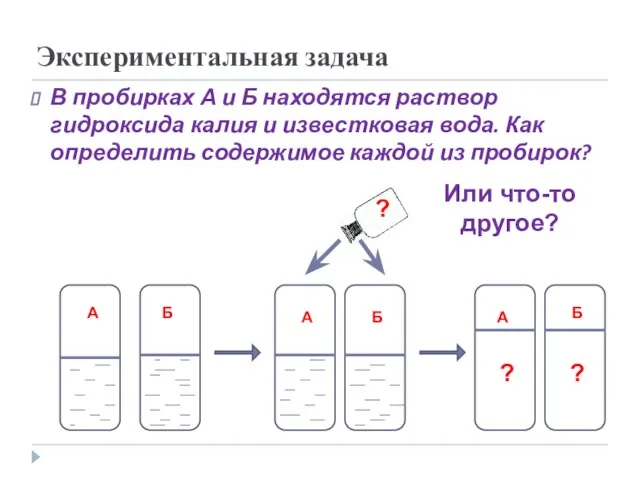
- 21. Экспериментальная задача В пробирках А и Б находятся раствор гидроксида калия и известковая вода. Как определить
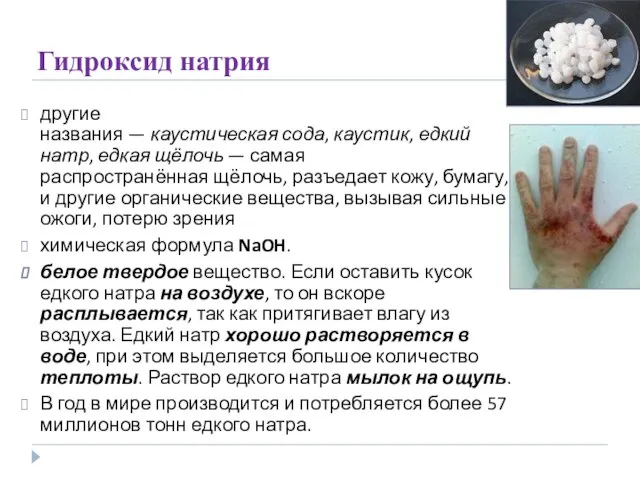
- 22. Гидроксид натрия другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь — самая распространённая щёлочь,
- 23. Историческая справка о NaOH До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия.
- 24. Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: в целлюлозно-бумажной промышленности для делигнификации
- 25. Использование NaOH Гидроксид натрия также используется в сочетании с цинком для фокуса. Медную монету кипятят в
- 26. Гидроксид калия «калиевый щёлок» — KOH. Тривиальные названия: едкое кали, каустический поташ. Бесцветные, очень гигроскопичные кристаллы,
- 27. Применение гидроксида калия В пищевой промышленности зарегистрирован в качестве пищевой добавки E525. для получения метана, поглощения
- 28. Техника безопасности при работе с NaOH и KOH При контакте слизистых поверхностей с едкой щёлочью необходимо
- 29. Составить формулы оксидов, соответствующих гидроксидам Например: Гидроксид калия – К+1ОН – оксид калия К+12О Гидроксид натрия
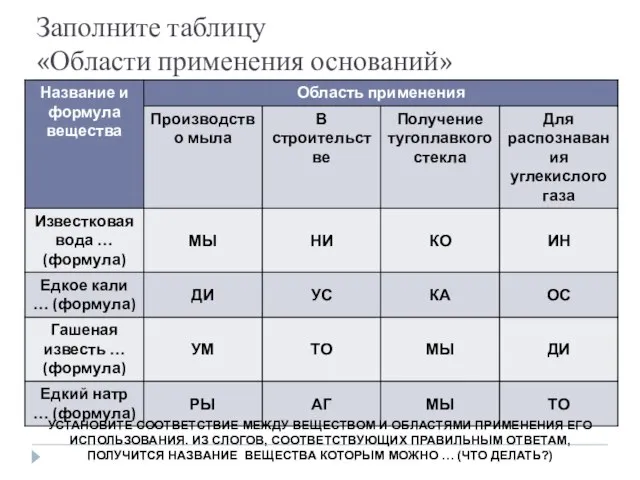
- 30. Заполните таблицу «Области применения оснований» УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ ВЕЩЕСТВОМ И ОБЛАСТЯМИ ПРИМЕНЕНИЯ ЕГО ИСПОЛЬЗОВАНИЯ. ИЗ СЛОГОВ,
- 31. РЕШИТЕ ЗАДАЧИ Вычислите количество вещества, которое составляют 342 г гидроксида бария. Сколько ионов каждого вида будет
- 32. Домашнее задание Параграф 19 Упражнения 2-6 (стр. 101-102)
- 34. Скачать презентацию






















 Изучение пенопласта
Изучение пенопласта Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия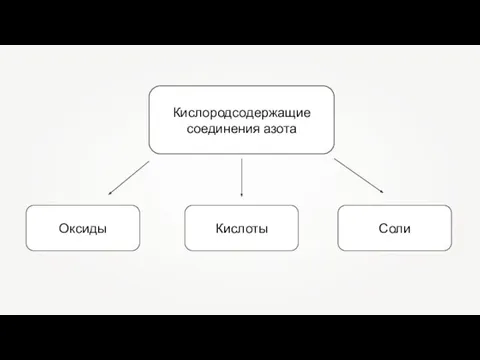 Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Химия. Введение в предмет (8 класс)
Химия. Введение в предмет (8 класс) Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный
Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Классы неорганических веществ
Классы неорганических веществ Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Презентация на тему Золото
Презентация на тему Золото  Дизельное топливо
Дизельное топливо Презентация на тему Производство серной кислоты
Презентация на тему Производство серной кислоты  Многоатомные спирты
Многоатомные спирты Вещество и тело. Чистые вещества и смеси
Вещество и тело. Чистые вещества и смеси Кристаллы. Виды
Кристаллы. Виды Растворы, растворимость
Растворы, растворимость Кислород. 8 класс
Кислород. 8 класс Химия в быту
Химия в быту Разветвленные цепные реакции
Разветвленные цепные реакции ОВР химияПрезентация
ОВР химияПрезентация Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Виды работ на уроках химии
Виды работ на уроках химии Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Формирование УУД и познавательных приемов на уроках химии
Формирование УУД и познавательных приемов на уроках химии ОВР - метод полуреакции
ОВР - метод полуреакции Презентация на тему Неметаллы
Презентация на тему Неметаллы  Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях