Содержание
- 2. Учение о химических процессах. Две части: 1. Химическая термодинамика; 2. Химическая кинетика. Химическая термодинамика – раздел
- 3. Система – совокупность тел, выделенных из окружающей среды анализа. Эти тела находятся во взаимодействии между собой,
- 4. Виды систем в термодинамике 1. Изолированная система – такая, которая не обменивается с окружающей средой ни
- 5. Состояние системы задается термодинамическими переменными, в роли которых выступают основные термодинамические свойства системы. Основные свойства: P
- 6. Для т/д описания систем используются термодинамические функции термодинамических переменных: Q – теплота процесса, A – работа,
- 8. Некоторые из термодинамические функций являются функциями состояния, они однозначно определяют состояние системы если она находится в
- 9. Выделяют экстенсивные и интенсивные термодинамические свойства и функции. Экстенсивные свойства зависят от количества веществ (например, m,
- 10. Первое начало термодинамики «Энергия в природе не уничтожается и не возникает вновь, а переходит из одного
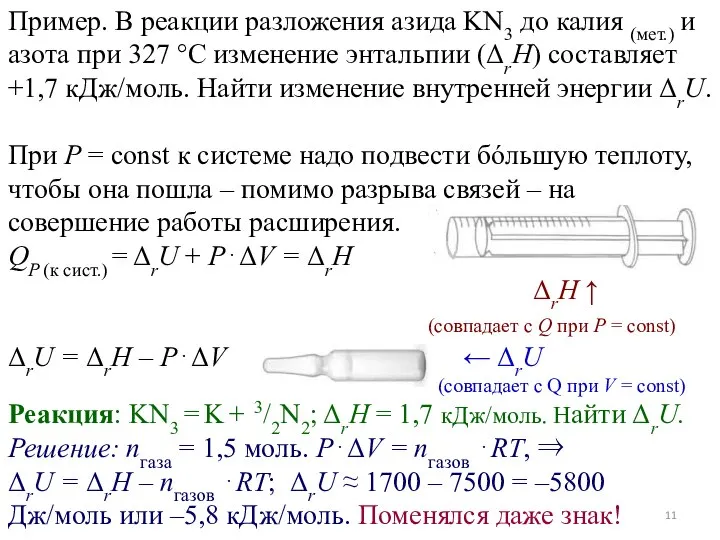
- 11. Пример. В реакции разложения азида KN3 до калия (мет.) и азота при 327 °С изменение энтальпии
- 12. Закон Гесса – следствие 1 начала термодинамики. Закон Гесса: тепловые эффекты химической реакции QV и QP,
- 13. Пример: Найти энтальпию реакции I2тв + Cl2газ = 2IClтв. (ΔrH1) если известны энтальпии реакций I2тв +
- 14. Важнейшие следствия из закона Гесса: Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов
- 15. Пример этих следствий. Требуется определить энтальпию формирования CrO3 из хрома (мет.) и кислорода (ΔfHx). Напрямую её
- 16. Из цикла имеем: ΔfHx + ΔrH1 + ΔrH2 + ΔrH3 = 0. С учетом ΔrH3 =
- 17. Пример одного из следствий из закона Гесса:
- 18. Второе начало термодинамики «Невозможно превратить какое-то количество теплоты полностью в работу: часть теплоты при этом оказывается
- 19. G = H – T⋅S – энергия Гиббса, функция состояния, одна из важнейших т/д функций. Amax
- 21. Скачать презентацию
















 Формирование универсальных учебных действий на уроках химии средствами интерактивного обучения
Формирование универсальных учебных действий на уроках химии средствами интерактивного обучения Растительные жиры. Пальмовое масло
Растительные жиры. Пальмовое масло Фосфорные удобрения
Фосфорные удобрения Коррозия металлов
Коррозия металлов Метанол. Краткая характеристика
Метанол. Краткая характеристика Празеодим
Празеодим Кислород и водород. Сходства и различия
Кислород и водород. Сходства и различия Износостойкие стали и сплавы
Износостойкие стали и сплавы Обобщение знаний об основных классах неорганических соединений
Обобщение знаний об основных классах неорганических соединений Презентация на тему Спирты (10 класс)
Презентация на тему Спирты (10 класс)  Белки. Структура белков
Белки. Структура белков История открытия водорода. Получение и физические свойства водорода
История открытия водорода. Получение и физические свойства водорода Относительная молекулярная массa. Химический диктант
Относительная молекулярная массa. Химический диктант Распределение электронов по энергетическим уровням
Распределение электронов по энергетическим уровням Синтетические материалы
Синтетические материалы Кремний
Кремний Органические цепочки
Органические цепочки Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Железо как химический элемент
Железо как химический элемент Соли: получение
Соли: получение Соли азотной кислоты- нитраты
Соли азотной кислоты- нитраты Основные классы неорганических соединений
Основные классы неорганических соединений Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М Галогены - простые вещества
Галогены - простые вещества Гидролиз солей
Гидролиз солей Турнир Знатоков Химии
Турнир Знатоков Химии Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!?