Содержание
- 2. План: Положение галогенов в ПСХЭ Д.И.Менделеева Строение атомов галогенов Строение молекул галогенов Физические свойства галогенов Химические
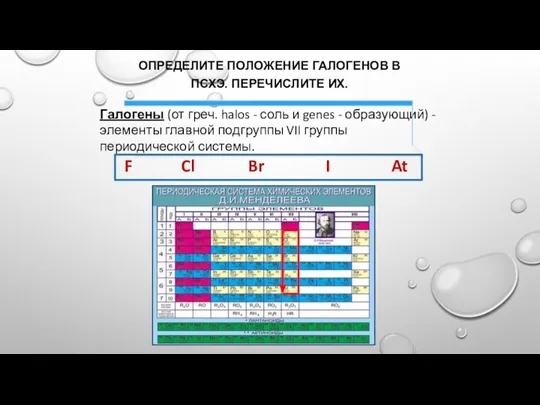
- 3. ОПРЕДЕЛИТЕ ПОЛОЖЕНИЕ ГАЛОГЕНОВ В ПСХЭ. ПЕРЕЧИСЛИТЕ ИХ. Галогены (от греч. halos - соль и genes -
- 4. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА: ПОЛОЖЕНИЕ В ПСХЭ И СТРОЕНИЕ АТОМОВ: VII ГРУППА ГЛАВНАЯ ПОДГРУППА
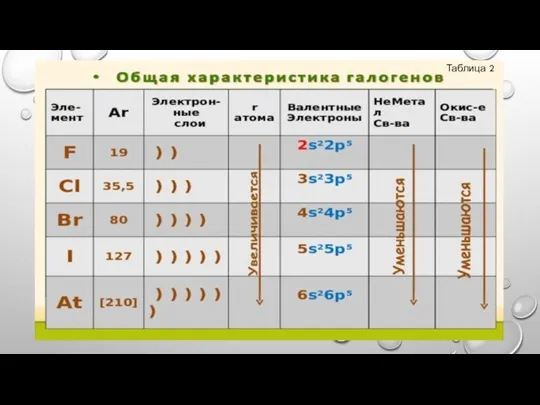
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ: НА ВНЕШНЕМ УРОВНЕ 7 ЭЛЕКТРОНОВ; УВЕЛИЧИВАЕТСЯ РАДИУС АТОМОВ; ОСЛАБЕВАЮТ НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА; ОКИСЛИТЕЛЬНАЯ СПОСОБНОСТЬ
- 6. СТРОЕНИЕ АТОМОВ ГАЛОГЕНОВ: НА ВНЕШНЕМ ЭНЕРГЕТИЧЕСКОМ УРОВНЕ ПО 7 ЭЛЕКТРОНОВ. МАЛЫЙ РАДИУС АТОМА (В СРАВНЕНИИ С
- 7. ВОЗМОЖНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ ГАЛОГЕНОВ ПОСТОЯННАЯ ПЕРЕМЕННАЯ ТОЛЬКО У F У ВСЕХ ОСТАЛЬНЫХ (-1) ГАЛОГЕНОВ (-1,+1, +3,
- 8. Заполнить таблицу в тетради с помощью Периодической системы химических элементов Д.И. Менделеева (в пустые ячейки таблицы
- 9. Таблица 2
- 10. ГАЛОГЕНЫ КАК ПРОСТЫЕ ВЕЩЕСТВА 1. Г2 - ОБЩАЯ ФОРМУЛА ГАЛОГЕНОВ- ПРОСТЫХ ВЕЩЕСТВ. 2. ТИП ХИМИЧЕСКОЙ СВЯЗИ
- 11. 4. ВОЗМОЖНЫЕ АГРЕГАТНЫЕ СОСТОЯНИЯ газообразное жидкое твёрдое F Cl Br I ХЛОР БРОМ ЙОД 5. Разная
- 12. 6. ТЕМПЕРАТУРЫ КИПЕНИЯ И ПЛАВЛЕНИЯ С УВЕЛИЧЕНИЕМ АТОМНОЙ МАССЫ ГАЛОГЕНОВ УВЕЛИЧИВАЮТСЯ ГАЛОГЕНЫ КАК ПРОСТЫЕ ВЕЩЕСТВА
- 13. 7. ВСЕ ГАЛОГЕНЫ – ТОКСИЧНЫЕ ВЕЩЕСТВА! Жидкий хлор вызывает серьезные ожоги кожи. Газообразный хлор оказывает сильное
- 14. Таблица 3
- 15. ХИМИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНОВ ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ: А) С ВОДОРОДОМ Н2 Н2 + Г2 = 2НГ
- 17. Скачать презентацию












 Основной государственный экзамен. Химия 2022. Задание 2
Основной государственный экзамен. Химия 2022. Задание 2 Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Тест по химии. ГИА
Тест по химии. ГИА Белки. Структуры белков
Белки. Структуры белков 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov ОВР. Реакции
ОВР. Реакции Основные понятия органической химии
Основные понятия органической химии Кремний и его соединения
Кремний и его соединения Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Химическае препараты
Химическае препараты Теоретические основы процессов получения и переработки полимерных материалов
Теоретические основы процессов получения и переработки полимерных материалов Арены. Бензол
Арены. Бензол Вода знакомая и не знакомая
Вода знакомая и не знакомая Полипропилен (ПП)
Полипропилен (ПП) Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Знаки химических элементов
Знаки химических элементов Реакции поликонденсации
Реакции поликонденсации Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Кислород
Кислород Вещество как система. Номенклатура неорганических веществ
Вещество как система. Номенклатура неорганических веществ Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Коррозия металлов
Коррозия металлов Свойства и применение серы
Свойства и применение серы Опасная бытовая химия!
Опасная бытовая химия! Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Пентоза - відновлювальна сировина для синтезу фуранових сполук
Пентоза - відновлювальна сировина для синтезу фуранових сполук