Слайд 2Инструкция для обучающихся по заочному курсу «Общая химия для 12 класса»
Категория обучающихся:

материалы данной презентации предоставляются обучающемуся для самостоятельного изучения темы «Вещества и их свойства», из курса общей химии 12 класса.
Содержание курса: включает 5 презентаций тем. Каждая учебная тема содержит четкую структуру учебного материала по конкретной теме, последний слайд контрольный тест – задания для самоконтроля.
Срок обучения по данному курсу: от одной недели до двух месяцев (определяется индивидуально).
Контроль знаний: учащийся предоставляет отчет о выполнении тестовых заданий – лист с вариантами заданий, с указанием темы.
Оценивание результата: «3» - выполнено 50% заданий, «4» - 75%, «5» - 100 % заданий.
Результат обучения: зачет (незачет) изученной темы.
Слайд 3Амфотерные соединения
Такими являются в неорганической химии: Аl(ОН)3, Zn(ОН)2, Cr(ОН)3, Ве(ОН)2, Gе(ОН)2, Sn(ОН)4,

Pb(ОН)2 и др.
В органической химии типичными представителями являются аминокислоты:
O
H2N – CH – C a - аминокислота
R OH
Слайд 4В реакциях с кислотами амфотерные оксиды ведут себя как основные оксиды
Например:
Аl2О3

+ 6НСl = 2АlСl3 + ЗН2О
В реакциях со щелочами амфотерные оксиды ведут себя как кислотные оксиды
Например:
Аl2О3 + 2NаОН = 2NаАlО2 + Н2О
Слайд 5Амфотерные гидроксиды взаимодействуют с растворами кислот и ведут себя как нерастворимые основания

Аl(ОН)3 + ЗНСl = АlСl3 + ЗН2О
При взаимодействии с растворами щелочей амфотерные гидроксиды ведут себя как слабые кислоты:
Аl(ОН)3 + NаОН = NаАlО2 + 2Н2О
Слайд 6Свойства аминокислот
NH2 – CH – C O OH
R
Аминогруппа, –

NH2 – акцептор водорода, определяет основные свойства аминокислот;
Карбоксильная группа, – COOH - донор водорода, определяет кислотные свойства аминокислот.
Слайд 7Кислотные свойства аминокислот
NH2 – R – COOH + NaOH =
NH2

– R – COONa + H2O
Слайд 8Основные свойства аминокислот
COOH – R – NH2 + HCl =
COOH

– R – NH3 Cl







 Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна
Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна Полезные кирпичи окружающего мира
Полезные кирпичи окружающего мира Положительно (+) заряженные частицы. Катионы
Положительно (+) заряженные частицы. Катионы Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Задания для подготовки к ЕГЭ по химии
Задания для подготовки к ЕГЭ по химии Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Средства ухода за кожей
Средства ухода за кожей 4_Жиры 2020
4_Жиры 2020 Алкены. Тестирование
Алкены. Тестирование Водные биоресурсы и аквакультура. Расчеты в объемном анализе
Водные биоресурсы и аквакультура. Расчеты в объемном анализе ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Загадки химии. Занятие 4
Загадки химии. Занятие 4 Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток  Супер-химия. Викторина
Супер-химия. Викторина Шуточные загадки Периодической системы химических элементов
Шуточные загадки Периодической системы химических элементов Кислоты. Состав кислот, их классификация и физические свойства, 8 класс
Кислоты. Состав кислот, их классификация и физические свойства, 8 класс Путешествие в мир кислот
Путешествие в мир кислот Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Презентация на тему Полисахариды
Презентация на тему Полисахариды  Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа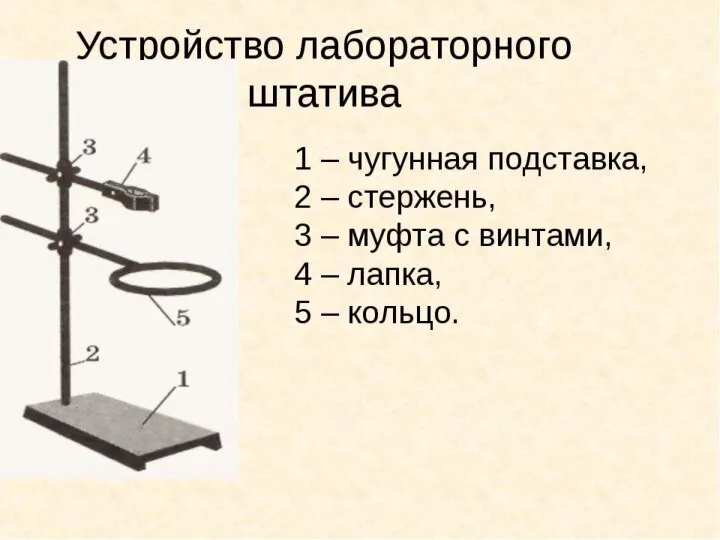 Устройство лабораторного штатива
Устройство лабораторного штатива Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой