Содержание
- 2. Алгоритм расстановки коэффициентов методом электронного баланса: 1. Определить степени окисления элементов в реагентах и продуктах реакции.
- 3. 2. Подчеркнуть элементы, степени окисления которых изменяются. Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
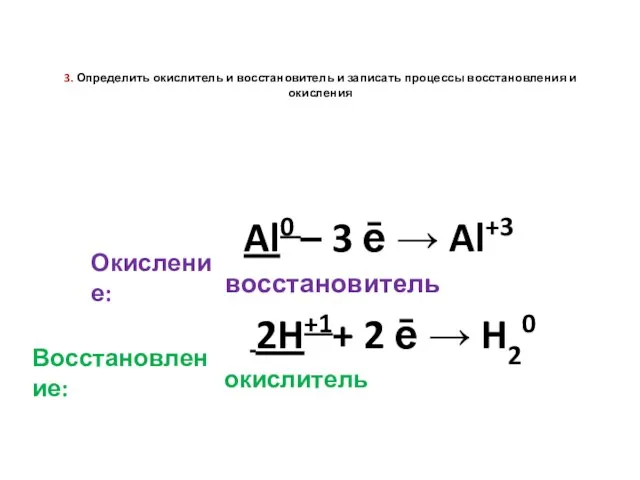
- 4. 3. Определить окислитель и восстановитель и записать процессы восстановления и окисления Окисление: Al0 – 3 ē
- 5. 4. Указываем число отданных и принятых электронов и находим наименьшее общее кратное. Al0 – 3 ē
- 6. 5. Расставляем коэффициенты перед формулами окислителя и восстановителя. Al + HCl → AlCl3 + H2 2
- 8. Скачать презентацию




 Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова презентация арены 1
презентация арены 1 Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1)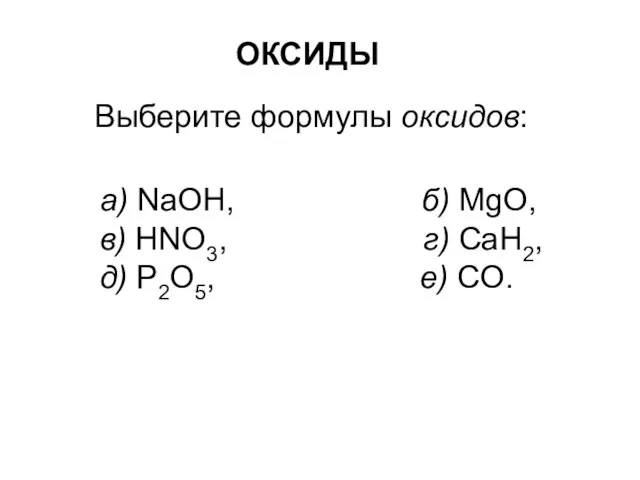 Оксиды
Оксиды Алкены. Химические и физические свойства
Алкены. Химические и физические свойства Контрольна робота, хімія
Контрольна робота, хімія alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 Природный газ
Природный газ Строение атома. Химия, 8 класс
Строение атома. Химия, 8 класс Типы химической связи и кристаллических решеток
Типы химической связи и кристаллических решеток Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Опыты с хондроитин сульфатом
Опыты с хондроитин сульфатом ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Водород
Водород Химия в быту
Химия в быту Золото
Золото 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Применение солей
Применение солей Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Презентация на тему Органическая химия. Жиры
Презентация на тему Органическая химия. Жиры  Электролиз
Электролиз Кинетика физико-химических процессов
Кинетика физико-химических процессов Виды химической связи
Виды химической связи Школа юных ученых. Соль
Школа юных ученых. Соль Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Простые вещества – неметаллы. Получение и химические свойства неметаллов
Простые вещества – неметаллы. Получение и химические свойства неметаллов Занимательная химия Программу составил
Занимательная химия Программу составил