Содержание
- 2. Задачи количественного анализа: - установление количества элементов, функциональных групп в веществе или веществ в материале; определение
- 3. Важнейшие методы количественного анализа гравиметрический титртметрический
- 4. Титриметрический анализ объединяет группу методов количественного анализа, основанных на измерении объема раствора точной концентрации, необходимого для
- 5. Титрование - основной прием метода, который заключается в постепенном добавлении к определенному веществу реагента точной концентрации
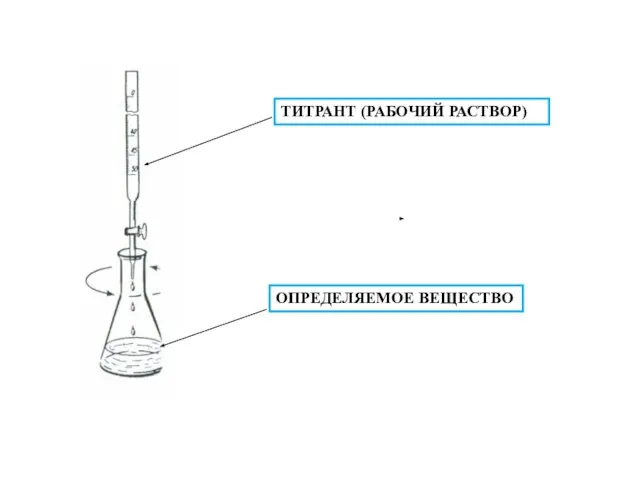
- 6. Титрант - раствор, с помощью которого производится титриметрическое определение, т. е. раствор, которым титруют.
- 8. При ТИТРОВАНИИ расходуется количество реагента, эквивалентное количеству тированного вещества в соответствии со стехиометрией реакции между ними,
- 9. Известно, что объемы растворов, количественно реагирующих между собой, обратно пропорциональны молярным концентрациям эквивалента этих растворов: Сэ1
- 10. Условия титриметрического определения: а) точное измерение объемов реагирующих веществ; б) приготовление растворов точно известной концентрации, с
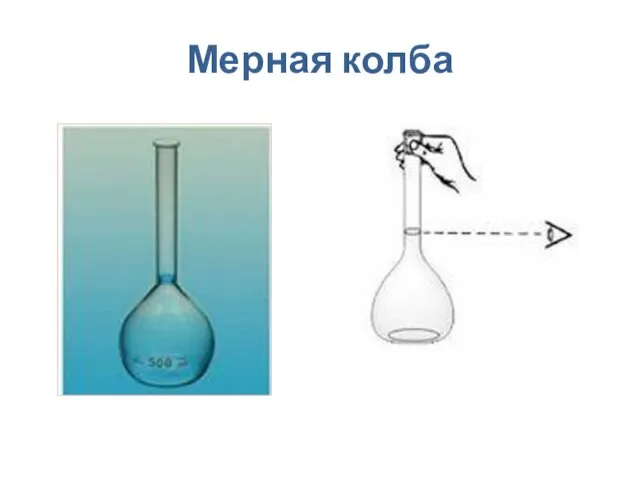
- 11. Мерная колба
- 12. Цилиндры, мензурки
- 13. Бюретки
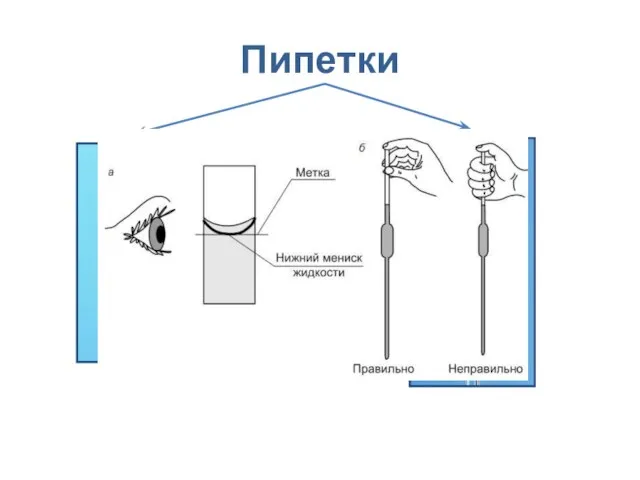
- 14. Пипетки
- 15. Условия титриметрического определения: а) точное измерение объемов реагирующих веществ; б) приготовление растворов точно известной концентрации, с
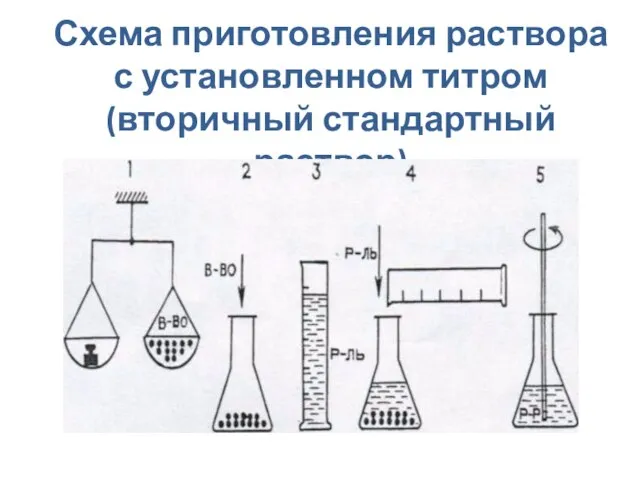
- 16. Схема приготовления раствора с установленном титром (вторичный стандартный раствор)
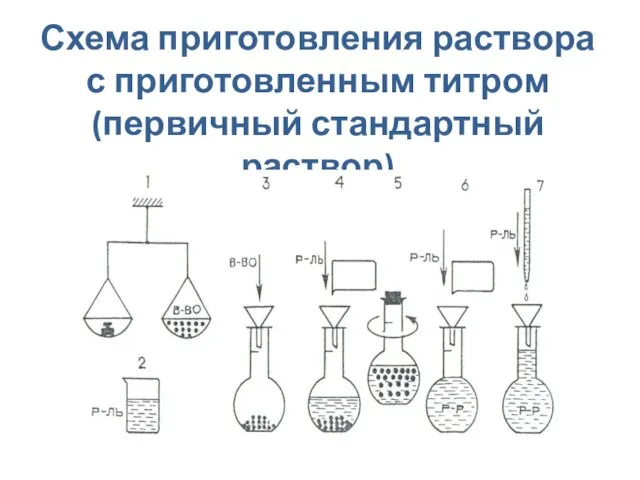
- 17. Схема приготовления раствора с приготовленным титром (первичный стандартный раствор)
- 18. Приготовление из фиксанала Фиксаналы - запаянные стеклянные ампулы, с точными навесками реактивов.
- 19. Для определения точной концентрации титранта («установки титра», или стандартизации) пользуются так называемым исходным, или установочным, веществом.
- 20. Установочное вещество должно удовлетворять следующим требованиям: 1. Соответствие состава вещества его химической формуле. 2. Химическая чистота
- 21. Условия титриметрического определения: а) точное измерение объемов реагирующих веществ; б) приготовление растворов точно известной концентрации, с
- 22. Момент окончания реакции между взаимодействующими веществами называется точкой эквивалентности (теоретической точкой конца титрования).
- 23. На практике в процессе титрования фиксируют конечную точку титрования: I. Визуальный способ - контроль течения химической
- 24. Точка эквивалентности
- 26. Если в конечной точке изменение окраски индикатора происходит между близкими, трудно воспринимаемыми человеческим глазом переходами рекомендуется
- 27. «Свидетель» - раствор примерно такого же объема и состава, что и анализируемый раствор в конце титрования.
- 28. КООЭФИЦИЕНТ ПОПРАВКИ Кп - число, показывающее, во сколько раз приготовленный раствор крепче или слабее по сравнению
- 29. Рекомендуемая величина Кп для проведения анализа: 1. Государственная Фармакопея XIV издания Кп = 0,98-1,02 2. ГОСТ
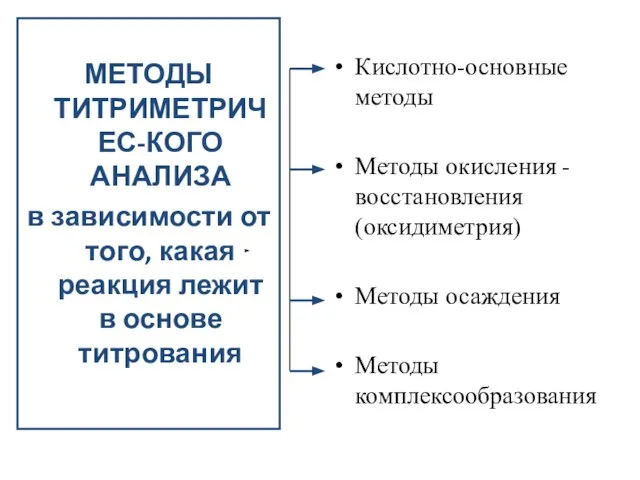
- 30. МЕТОДЫ ТИТРИМЕТРИЧЕС-КОГО АНАЛИЗА в зависимости от того, какая реакция лежит в основе титрования Кислотно-основные методы Методы
- 31. Для того чтобы та или иная реакция могла служить основой для титрования, она должна удовлетворять ряду
- 32. Способы титрования: 1) прямое; 2) обратное; 3) титрование заместителя.
- 33. Прямое титрование- титрование анализируемого вещества титрованным раствором.
- 34. Прямое титрование HCl метилоранж На примере Соляной кислоты Титрант NaOH 0,1 моль/л
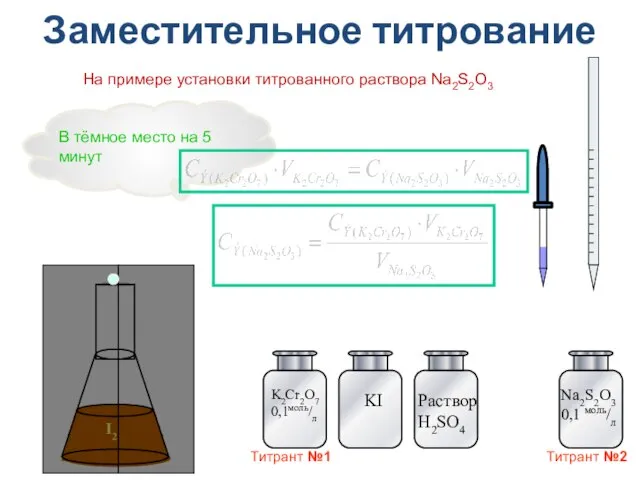
- 35. Заместительное титрование (по заместителю) - взаимодействие анализируемого вещества со вспомогательным реагентом, в результате которого выделяется эквивалентное
- 36. I2 Заместительное титрование На примере установки титрованного раствора Na2S2O3 Na2S2O3 0,1 моль/л В тёмное место на
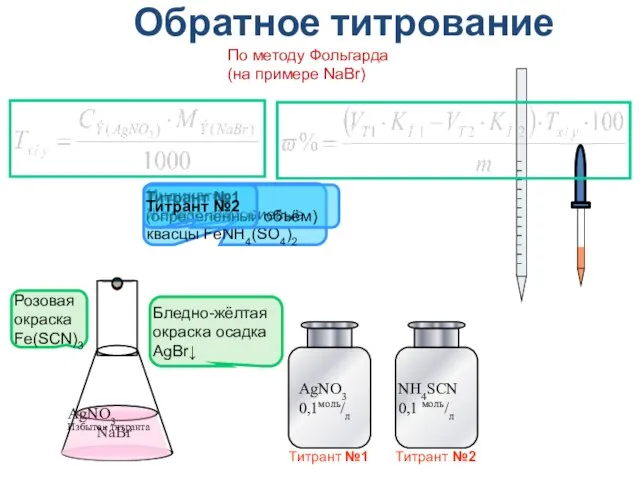
- 37. Обратное титрование (по остатку) - взаимодействие анализируемого вещества с избытком титранта, непрореагировавшая часть которого титруют вторым
- 38. Обратное титрование NaBr Индикатор Железо-аммониевые квасцы FeNH4(SO4)2 По методу Фольгарда (на примере NaBr) Титрант №1 (определённый
- 40. Скачать презентацию





























 Изучение пенопласта
Изучение пенопласта Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия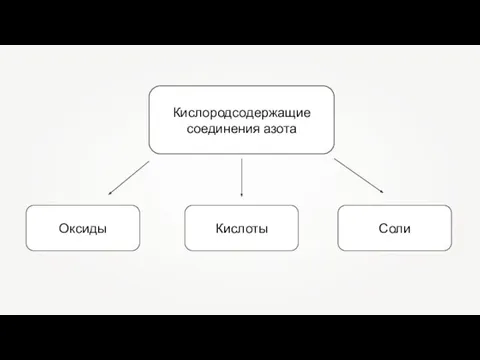 Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Химия. Введение в предмет (8 класс)
Химия. Введение в предмет (8 класс) Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный
Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Классы неорганических веществ
Классы неорганических веществ Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Презентация на тему Золото
Презентация на тему Золото  Дизельное топливо
Дизельное топливо Презентация на тему Производство серной кислоты
Презентация на тему Производство серной кислоты  Многоатомные спирты
Многоатомные спирты Вещество и тело. Чистые вещества и смеси
Вещество и тело. Чистые вещества и смеси Кристаллы. Виды
Кристаллы. Виды Растворы, растворимость
Растворы, растворимость Кислород. 8 класс
Кислород. 8 класс Химия в быту
Химия в быту Разветвленные цепные реакции
Разветвленные цепные реакции ОВР химияПрезентация
ОВР химияПрезентация Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Виды работ на уроках химии
Виды работ на уроках химии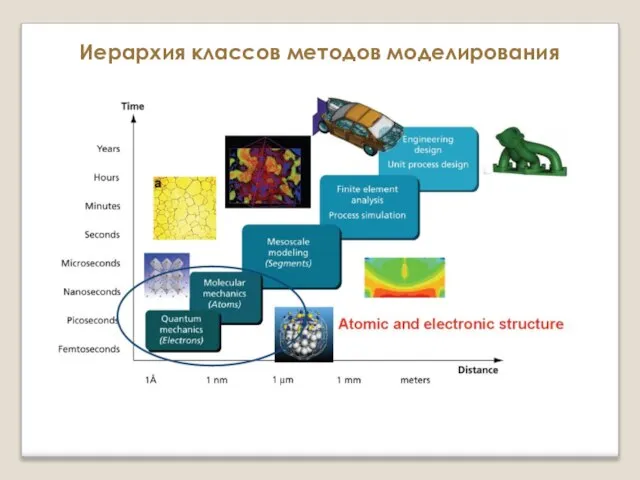 Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Формирование УУД и познавательных приемов на уроках химии
Формирование УУД и познавательных приемов на уроках химии ОВР - метод полуреакции
ОВР - метод полуреакции Презентация на тему Неметаллы
Презентация на тему Неметаллы  Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях