Слайд 2Содержание
Определение. Общая формула.
Классификация.
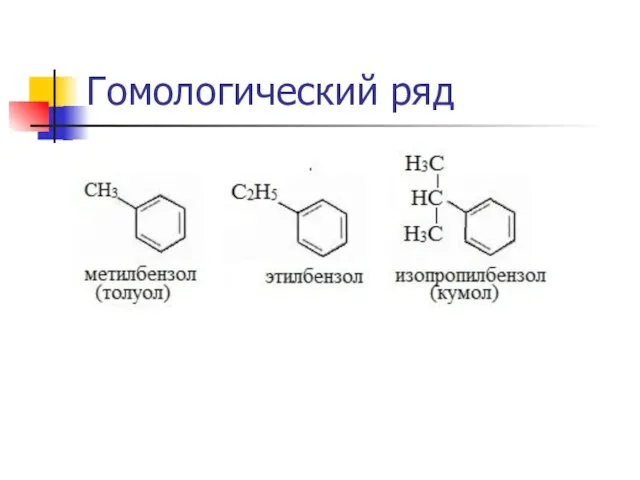
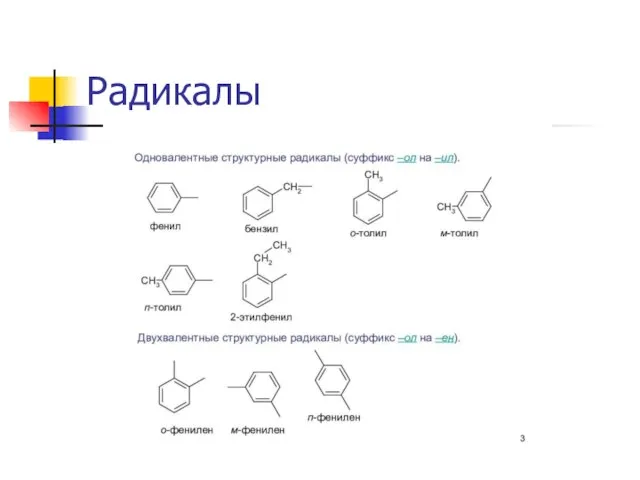
Гомологический ряд, радикалы.
Изомерия и номенклатура.
Строение (гибридизация).
Физические свойства.
Способы получения.
Химические свойства.
Применение.

Слайд 3Определение. Общая формула.
Арены или ароматические углеводороды - это соединения, молекулы которых содержат

устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула : СnH2n-6
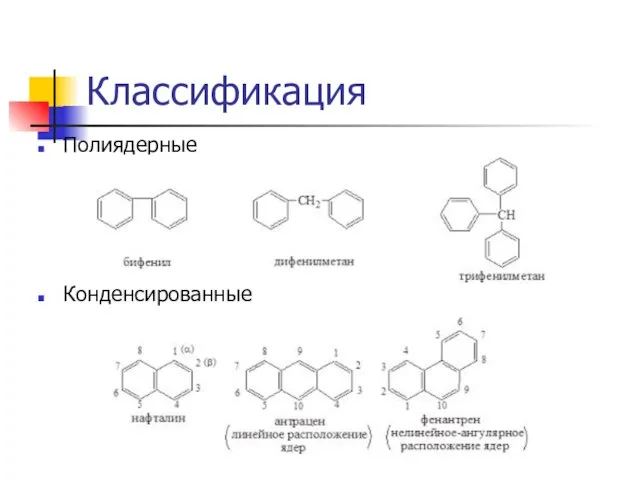
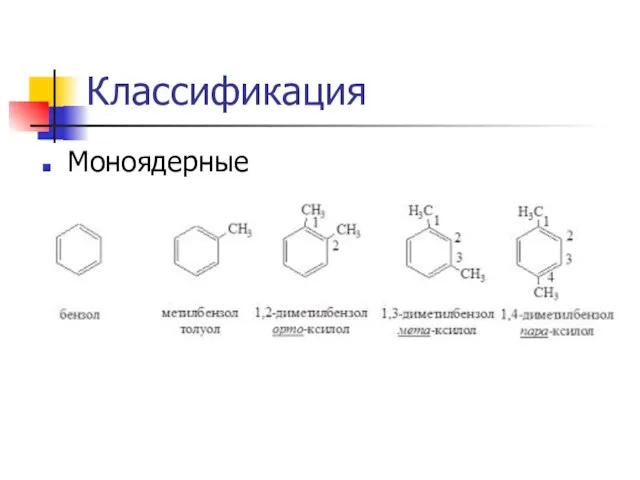
Слайд 5Классификация
Полиядерные
Конденсированные
Слайд 8Изомерия
Все следующие за метилбензолом гомологи бензола имеют изомеры.
Изомерия положения заместителей (орто-, мета-,
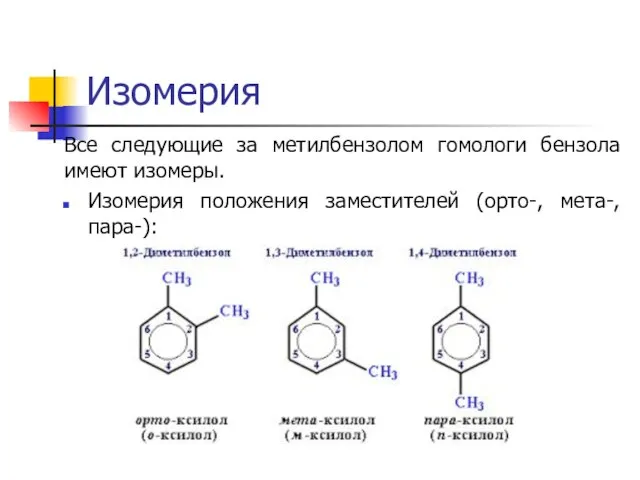
пара-):
Слайд 9Изомерия
Изомерия углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода:
Изопропилбензол
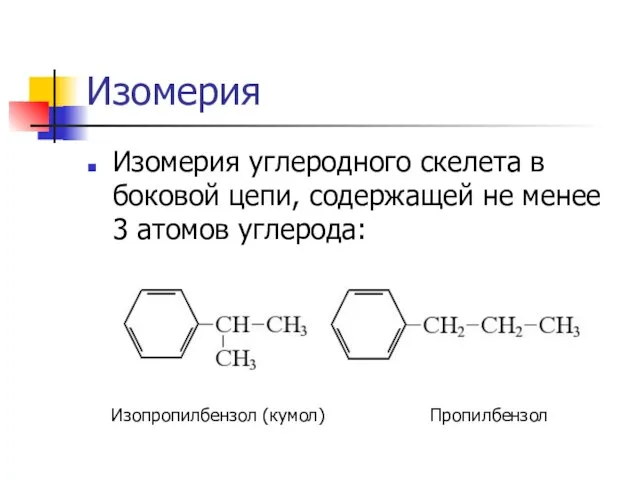
(кумол) Пропилбензол
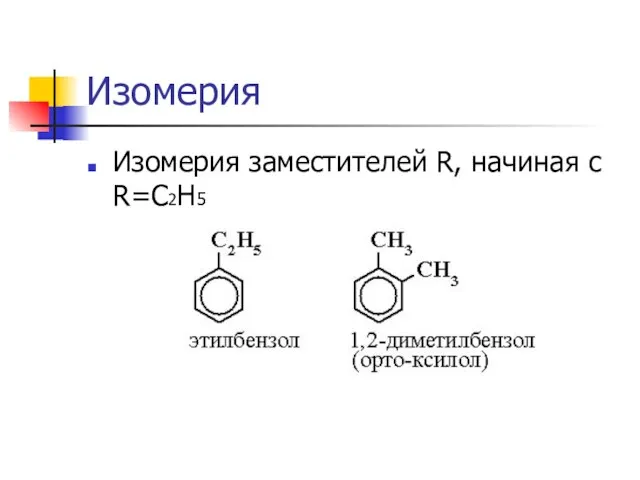
Слайд 10Изомерия
Изомерия заместителей R, начиная с R=C2H5
Слайд 11Номенклатура
Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень).
Если

радикалов 2 и более, их положение указывается номерами атомов углерода в бензольном кольце, с которыми они связаны.
Слайд 12Номенклатура
Нумеруют атомы углерода в бензольном кольце:
1) Начиная от старшего заместителя к младшему:

Слайд 13Номенклатура
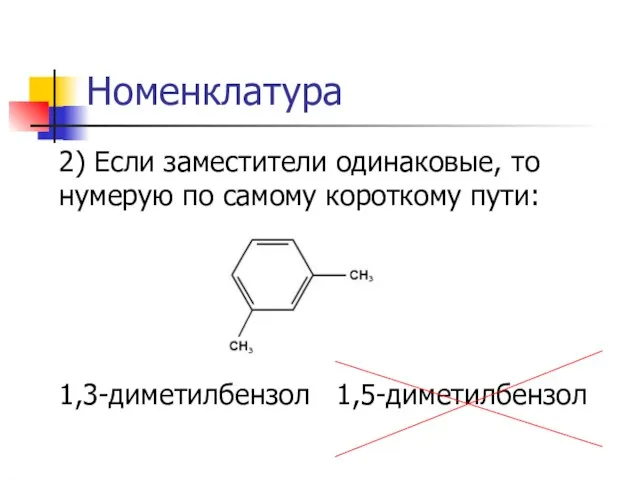
2) Если заместители одинаковые, то нумерую по самому короткому пути:
1,3-диметилбензол 1,5-диметилбензол
Слайд 14Номенклатура
Если заместителя 2, то можно указать их положение тривиальными (историческими) приставками:
орто- (о-)

– заместители у соседних атомов углерода (1,2);
мета- (м-) – заместители через один атом углерода (1,3);
пара- (п-) – заместители на противоположных сторонах конца (1,4).
Слайд 15Строение
Первое ароматическое соединение – бензол был открыт в 1825 г. М. Фарадеем.
В
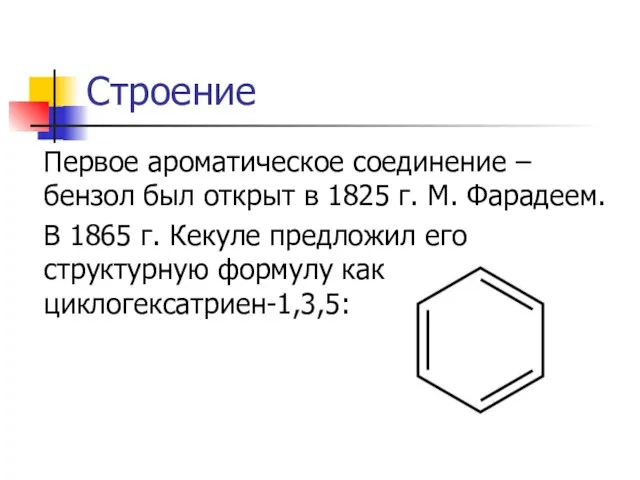
1865 г. Кекуле предложил его структурную формулу как циклогексатриен-1,3,5:
Слайд 16Строение
В формуле Кекуле непредельные (двойные) связи, следовательно, бензол должен иметь ненасыщенный характер

(легко вступать в реакции присоединения).
Экспериментально это было опровергнуто: бензол вступает в реакции присоединения только в жестких условиях, устойчив к окислению.
Слайд 17Строение
Пытаясь объяснить эти несоответствия, ученые предложили изображать бензол формулой (шестиугольник с окружностью
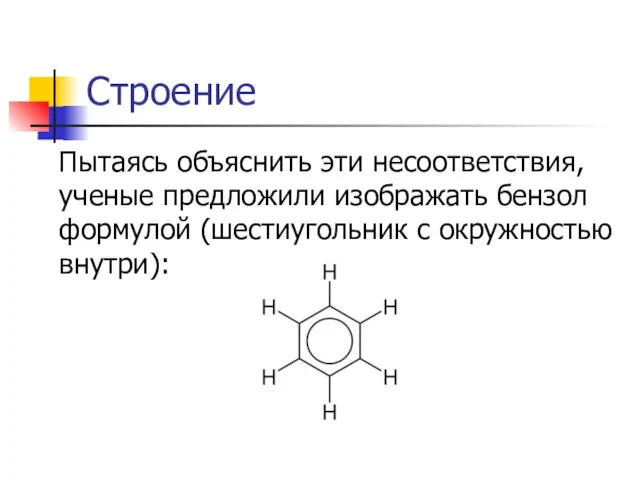
внутри):
Слайд 18Строение
Атомы углерода в молекуле бензола находятся в sp2-гибридизации и лежат в одной

плоскости.
Длина связи С-С: 0,139 нм.
Слайд 19Строение
Негибридизированные р-орбитали атомов углерода, составляющие двойные связи, ориентированы перпендикулярно плоскости кольца и
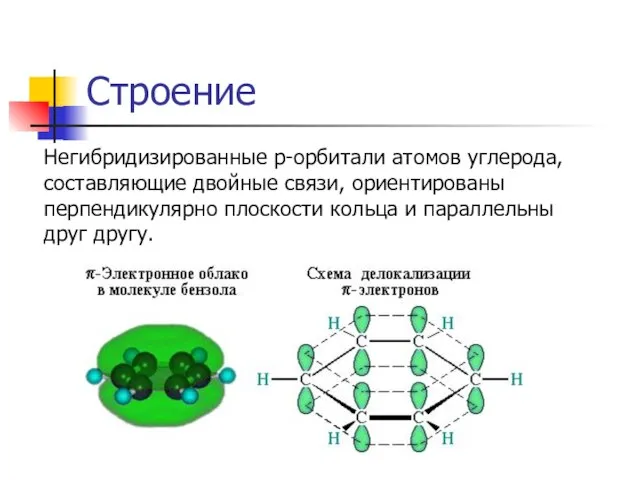
параллельны друг другу.
Слайд 20Физические свойства
Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости
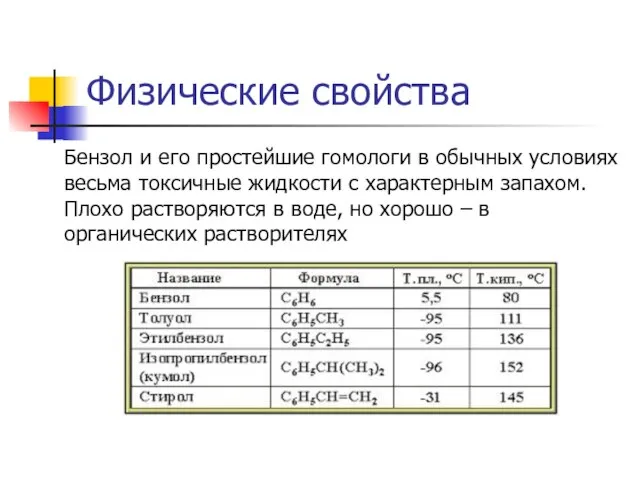
с характерным запахом. Плохо растворяются в воде, но хорошо – в органических растворителях
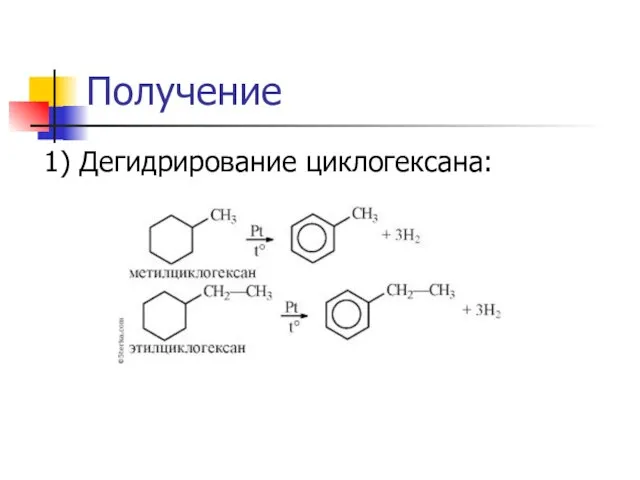
Слайд 21Получение
1) Дегидрирование циклогексана:
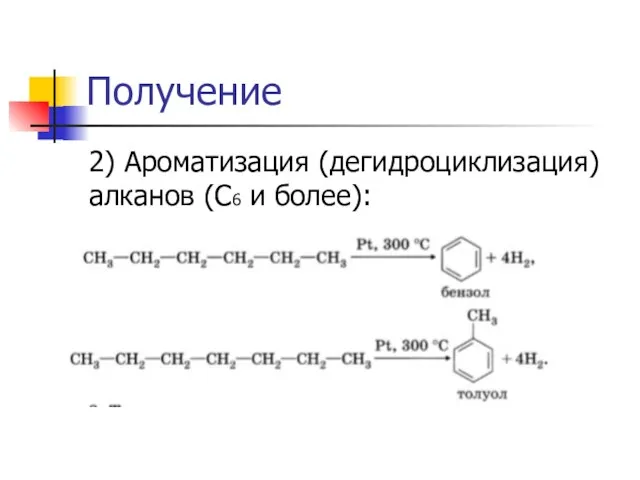
Слайд 22Получение
2) Ароматизация (дегидроциклизация) алканов (С6 и более):
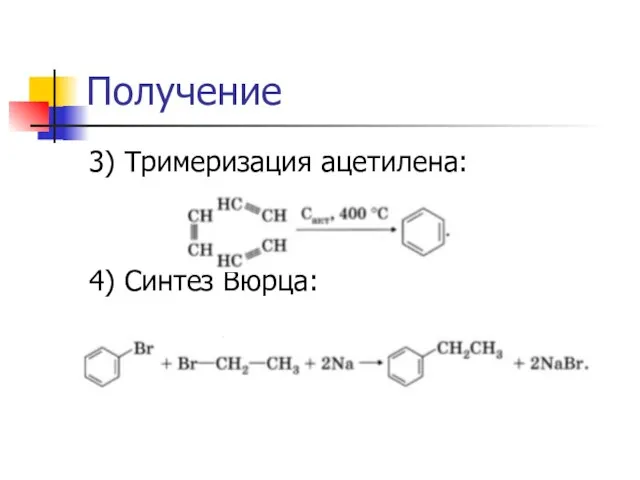
Слайд 23Получение
3) Тримеризация ацетилена:
4) Синтез Вюрца:
Слайд 24Получение
5) Алкилирование:
взаимодействие бензола и алкена в присутствии кислоты
реакция бензола с галогенпроизводным в
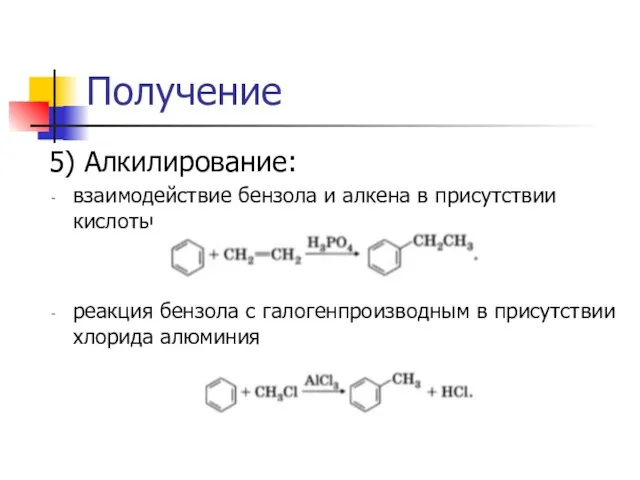
присутствии хлорида алюминия
Слайд 25Химические свойства
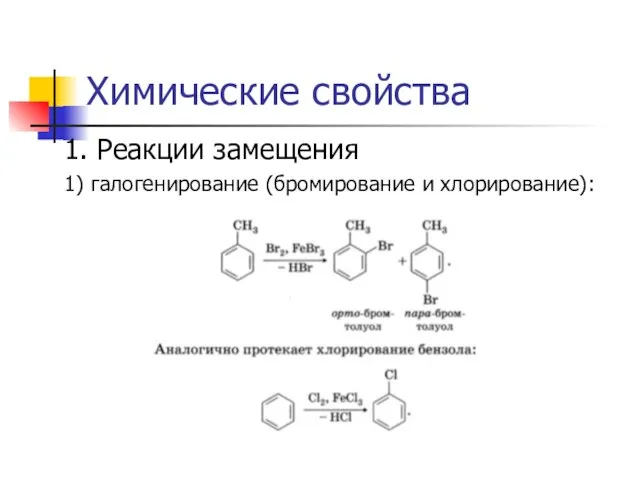
1. Реакции замещения
1) галогенирование (бромирование и хлорирование):
Слайд 26Химические свойства
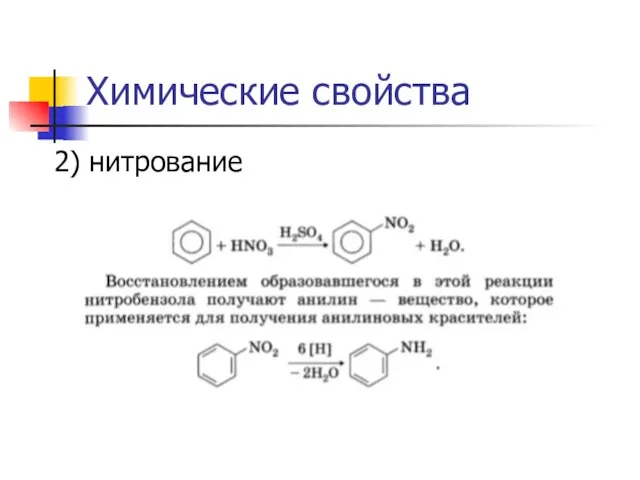
2) нитрование
Слайд 27Химические свойства
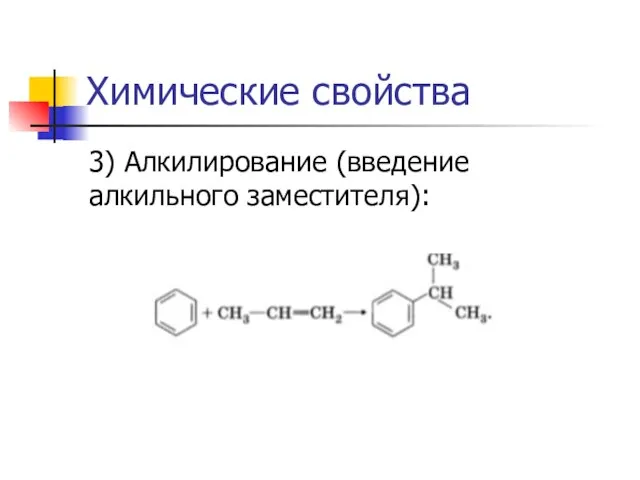
3) Алкилирование (введение алкильного заместителя):
Слайд 28Химические свойства
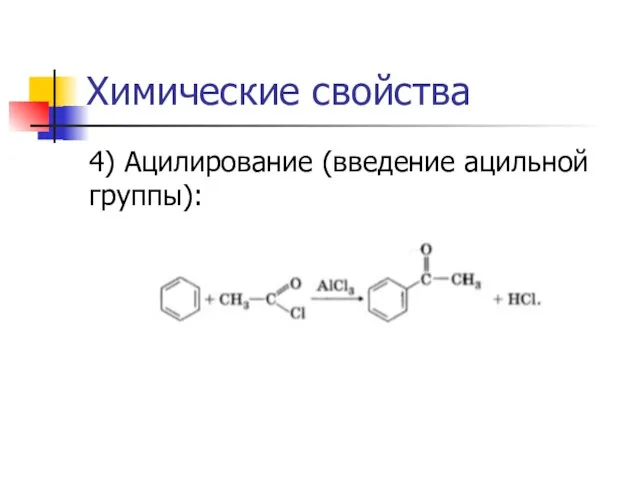
4) Ацилирование (введение ацильной группы):
Слайд 29Химические свойства
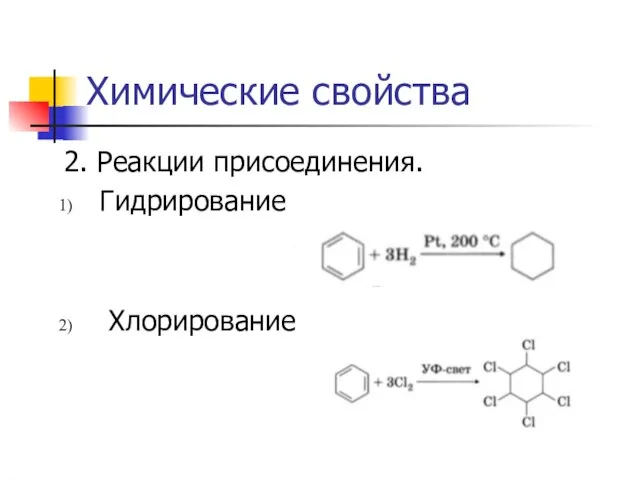
2. Реакции присоединения.
Гидрирование
Хлорирование
Слайд 30Химические свойства
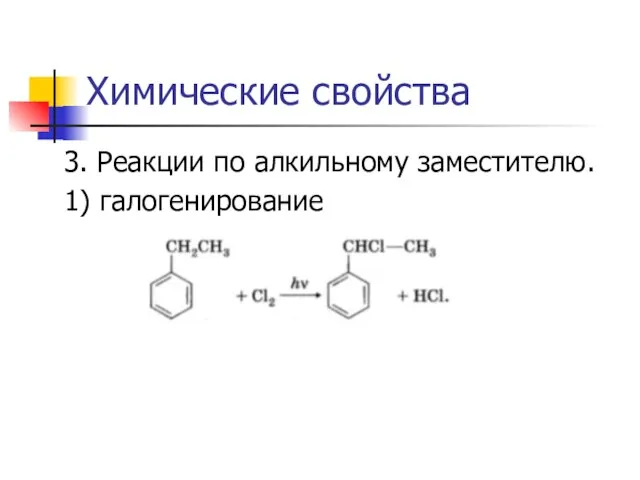
3. Реакции по алкильному заместителю.
1) галогенирование
Слайд 31Химические свойства
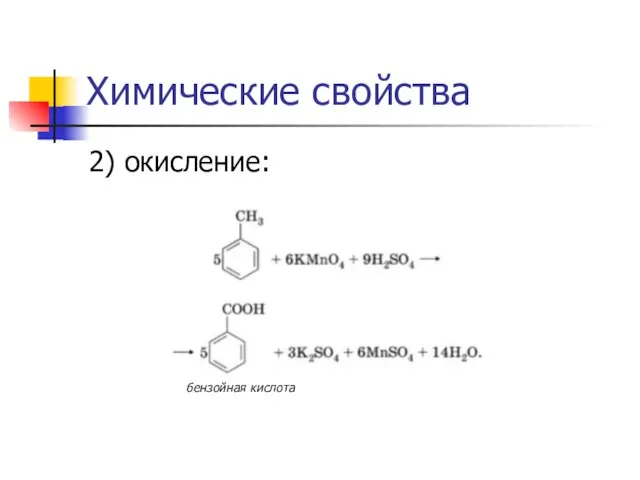
2) окисление:
бензойная кислота



























 Гальванический элемент
Гальванический элемент Учебная мотивация как показатель качества образования (на уроках химии)
Учебная мотивация как показатель качества образования (на уроках химии) Презентация по Химии "Классификация реакций в неорганической химии"
Презентация по Химии "Классификация реакций в неорганической химии"  Класс оксиды
Класс оксиды Основания
Основания Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Инертные газы
Инертные газы Презентация на тему Ионы и ионная химическая связь
Презентация на тему Ионы и ионная химическая связь  Чистые вещества и смеси
Чистые вещества и смеси Удивительные приборы: Термометр
Удивительные приборы: Термометр KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ;
KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ; Уравнение состояния
Уравнение состояния Енергетика хімічних процесів
Енергетика хімічних процесів Коррозия металлов
Коррозия металлов Графит (С)
Графит (С) Концепция химической связи
Концепция химической связи Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Кислоты и их свойства
Кислоты и их свойства Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения
Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения Оксид марганца
Оксид марганца Золото
Золото Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Переработка каменного угля. Коксование
Переработка каменного угля. Коксование Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН
Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН Железо 11 класс - Презентация_
Железо 11 класс - Презентация_ Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Полимеры. Применение
Полимеры. Применение Нефть и газ
Нефть и газ