Слайд 2Гидролиз -
от греч. «гидро» - вода,
«лизис» - разложение.

Слайд 3Гидролиз солей –
реакция обмена между солью и водой,
приводящая к образованию

слабого
электролита.
Слайд 44 типа солей:
соль, образованная
сильной кислотой и слабым основанием (ALCl3);
сильным основанием и

слабой кислотой (Na2S);
сильным основанием и сильной кислотой (NaCl);
слабым основанием и слабой кислотой (СН3СООNH4).
Слайд 5:
Соль, образованная сильной кислотой и слабым основанием.
AlCl3 → Al3+ + 3Cl-;
Н2О →
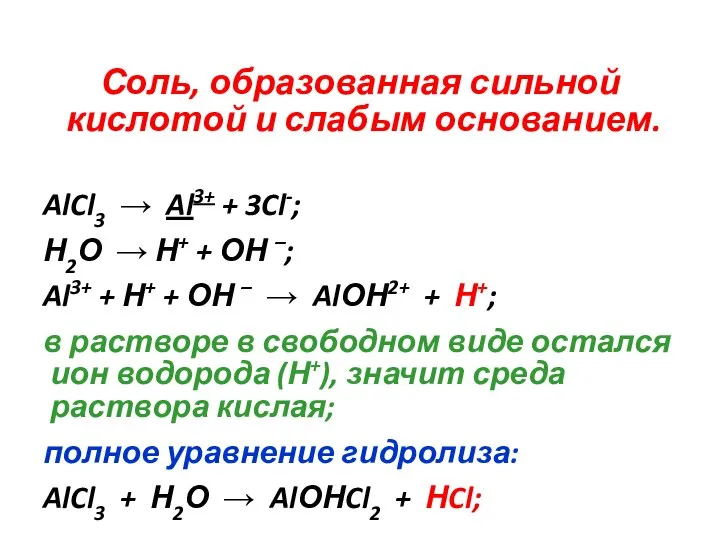
Н+ + ОН –;
Al3+ + Н+ + ОН – → AlОН2+ + Н+;
в растворе в свободном виде остался ион водорода (Н+), значит среда раствора кислая;
полное уравнение гидролиза:
AlCl3 + Н2О → AlОНCl2 + НCl;
Слайд 6Соль, образованная, сильным основанием и слабой кислотой.
Na2S ? 2Na++S2-
Н2О ?

Н+ + ОН –;
S2- + H2O ? HS– + OH-
в растворе в свободном виде остался гидроксид ион ( OH-), значит среда раствора щелочная.
Полное уравнение гидролиза
Na2S + H2O ? NaHS + NaOH
Слайд 7Соль, образованная сильным основанием и сильной кислотой
КСl + Н2О ↔

КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.
Слайд 8Соль, образованная слабым основанием и сильной кислотой.
CH3COONH4 ? CH3COO- +NH4+
Н2О →

Н+ + ОН –;
CH3COO- + NH4+ +H2O ? CH3COOH + NH3*H2O
CH3COONH4 + H2O ? CH3COOH + NH3*H2O
В этом случае гидролизу подвергаются как катион, так анион, образуются слабые электролиты, и среда раствора оказывается близкой к нейтральной или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.
Слайд 9Индикаторы –вещества, которые меняют окраску в зависимости от среды.








 Металлы. Своя игра
Металлы. Своя игра α-Аминокислоты
α-Аминокислоты Ионные уравнения реакций
Ионные уравнения реакций Жиры. Сложные эфиры
Жиры. Сложные эфиры Заполни электронные уровни элементов
Заполни электронные уровни элементов Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  8-11 2 валентность
8-11 2 валентность Кислоты и соли
Кислоты и соли Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Кипение. Испарение
Кипение. Испарение Презентация на тему Щелочные и щелочноземельные металлы
Презентация на тему Щелочные и щелочноземельные металлы  Ковалентная неполярная связь
Ковалентная неполярная связь Презентация на тему Железо и его соединения
Презентация на тему Железо и его соединения  Круговорот серы в природе
Круговорот серы в природе Подготовка к ГИА по химии
Подготовка к ГИА по химии Карбонаты. Лекция 12
Карбонаты. Лекция 12 Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Металлы и неметаллы
Презентация на тему Металлы и неметаллы  Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина карбоновые кислоты
карбоновые кислоты Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5