Содержание
- 2. Рассматриваемые вопросы 1. Аналитические реакции и способы их выполнения 2. Дробный и систематический анализ 3. Методы
- 3. 1. Аналитические реакции и способы их выполнения Аналитическая (или качественная) реакция — это химическая реакция, с
- 4. Наименьшее содержание определяемого компонента (Сх), при котором его можно обнаружить данным методом с заданной доверительной вероятностью
- 5. Аналитическая реакция тем чувствительнее, чем ниже предел обнаружения. Предел обнаружения зависит от: - концентрации реагентов; -
- 6. Классификация аналитических реакций: NH4+ + OH- ⇔ NH3↑ + H2O
- 8. В зависимости от количества исследуемого вещества, объема раствора и техники выполнения операций аналитические методы качественного анализа
- 9. 1. Макрометод - наиболее старый метод химического анализа, при котором для анализа берут сравнительно большие количества
- 10. 3. Полумикрометод - занимает промежуточное положение между макро- и микрометодом. Для анализа берут: 50 мг сухого
- 11. Анализ сухим путем осуществляют с помощью таких приемов, как проба на окрашивание пламени, получение цветных стекол
- 12. Окрашенные стекла, или перлы, приготовляют сплавлением исследуемого вещества с бурой Na2B407•10H2O (или с гидрофосфатом натрия-аммония NaNH4HPO4•4Н2О)
- 13. Анализ „сухим” путем используют главным образом в полевых условиях для качественного или полуколичественного исследования минералов и
- 14. Техника выполнения аналитических реакций По технике выполнения анализа все реакции обнаружения можно разделить на три группы:
- 15. 2) Капельные реакции выполняются на маленьком листочке фильтровальной бумаги, имеющем треугольную форму. На кусочек бумаги наносят
- 16. 3) Микрокристаллоскопические реакции (мкс) выполняются на предметном стекле, которое должно быть тщательно вымыто, ополоснуто дистиллированной водой
- 17. Условия выполнения аналитических реакций Четкий и однозначный результат анализа может быть получен только при соблюдении строго
- 18. Проверить среду или значение рН можно с помощью индикаторных бумаг. Лакмусовая индикаторная бумага бывает красной и
- 19. Более подробную информацию дает бумага, пропитанная универсальным индикатором (УИ). При смачивании ее анализируемым раствором она окрашивается
- 20. 2) Температура раствора. Многие реакции идут при нагревании, о чем обязательно говорится в руководстве. Нагревания требуют
- 21. 3) Количество добавляемого реагента. В отношении количества реактивов надо строго придерживаться прописи. Hg2+ + 2I- ⇔
- 22. 2. Дробный и систематический анализ
- 23. Специфические реакции позволяют обнаруживать ион в отдельной порции анализируемого раствора, не считаясь с присутствием других ионов.
- 24. Дробный анализ применяют агрохимические и заводские лаборатории, особенно в тех случаях, когда состав исследуемого материала достаточно
- 25. Допустим, что раствор нужно испытать на присутствие катиона Са2+, но в нем одновременно может содержаться и
- 26. Присутствие иона Са2+ не мешает обнаружению иона Bа2+ этой реакцией, так как хромат кальция СаСгО4 хорошо
- 27. Для этого на весь раствор действуют избытком хромата калия К2Сr04 (или дихромата калия К2Сr207), убеждаются, что
- 28. 3. Методы повышения чувствительности реакций При проведении химического анализа часто приходится решать задачи по открытию или
- 29. Разделение — это операция (процесс), в результате которой композиты, составляющие исходную смесь, отделяются друг от друга.
- 30. Различают абсолютное концентрирование и относительное конценmpupoeaнue Абсолютное концентрирование — это перевод микрокомпонента из большой массы (или
- 31. Методы разделения и концентрирования основаны на использовании различий в свойствах компонентов анализируемой системы, таких, как растворимость,
- 32. Озоление — метод, при котором исходный анализируемый материал путем термической обработки на воздухе превращают в минеральный
- 33. При сухом озолении анализируемый образец (1—5 г) помещают в фарфоровый, кварцевый или платиновый тигель, медленно нагревают,
- 34. При мокром озолении исходную навеску анализируемого вещества, помещенную в фарфоровый тигель, обрабатывают раствором соответствующего реактива (например,
- 35. Чувствительность реакции зависит от многих факторов и может быть повышена, если тем или иным способом увеличить
- 36. Метод ионного обмена. Для концентрирования ионов этим методом в качественном анализе используют так называемые ионообменные смолы
- 37. Метод экстрагирования. Экстрагирование - это один из видов фазового разделения веществ. Оно основано на том, что
- 38. Метод соосаждения. В раствор, содержащий следы определяемого иона, вводят посторонний катион (или анион), который и осаждают
- 39. В аналитической практике используются как неорганические (гидроокиси алюминия и железа, фосфат железа), так и органические соосадители
- 40. Электрохимические методы. Для разделения и идентификации компонентов смесей применяют методы электрофореза (электрофоретические методы), основанные на использовании
- 41. Электрофорез проводят либо в свободной незакрепленной среде (в свободной жидкости) — фронтальный электрофорез, либо в закрепленной
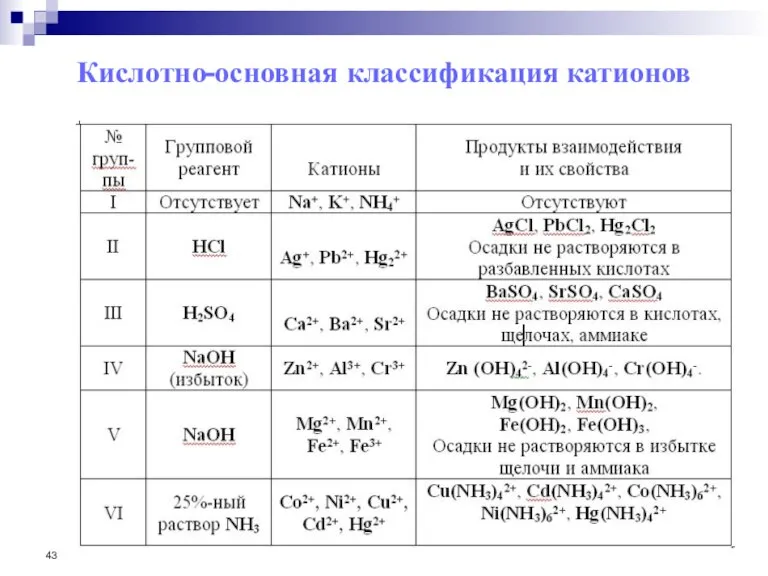
- 42. 4. Аналитическая классификация катионов В настоящее время существуют пять методов классификации ионов. Это сероводородный, аммиачно-фосфатный, дифталатный,
- 43. Кислотно-основная классификация катионов
- 44. Достоинства кислотно-основной классификации: 1) Использует основные свойства элементов – отношение к кислотам и щелочам, способность к
- 46. Скачать презентацию









































 Названия и формулы кислот
Названия и формулы кислот Электрохимия. Решение задач. ИДЗ 4
Электрохимия. Решение задач. ИДЗ 4 КВН по теме: Периодическая система химических элементов Д.И. Менделеева
КВН по теме: Периодическая система химических элементов Д.И. Менделеева Соли
Соли Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Липиды. Состав липидов
Липиды. Состав липидов Основания. Получение оснований
Основания. Получение оснований Борьба с загрязнением пластиковыми материалами
Борьба с загрязнением пластиковыми материалами 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Презентация на тему Вода – растворитель
Презентация на тему Вода – растворитель  Изучение основного солевого состава брендов бутилированной воды, присутствующих на рынке России
Изучение основного солевого состава брендов бутилированной воды, присутствующих на рынке России Типы химической связи и кристаллических решеток
Типы химической связи и кристаллических решеток Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Кремень – камень
Кремень – камень Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Лекция1Тов
Лекция1Тов Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Алкины. Строение, номенклатура, изометрия, физические свойства
Алкины. Строение, номенклатура, изометрия, физические свойства Презентация на тему А.М. Бутлерова
Презентация на тему А.М. Бутлерова  Нефтяные дисперсные системы
Нефтяные дисперсные системы Факторы, влияющие на скорость химических реакций
Факторы, влияющие на скорость химических реакций Химические свойства металлов
Химические свойства металлов Каучук негізіндегі материалдар
Каучук негізіндегі материалдар Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Проантоцианидины. Антиоксидантные и антирадикальные свойства
Проантоцианидины. Антиоксидантные и антирадикальные свойства Соединения серы
Соединения серы Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация