Содержание
- 2. Вещества Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы
- 3. Неэлектролиты вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы. газы,
- 4. Электролиты Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы. Неорганические
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
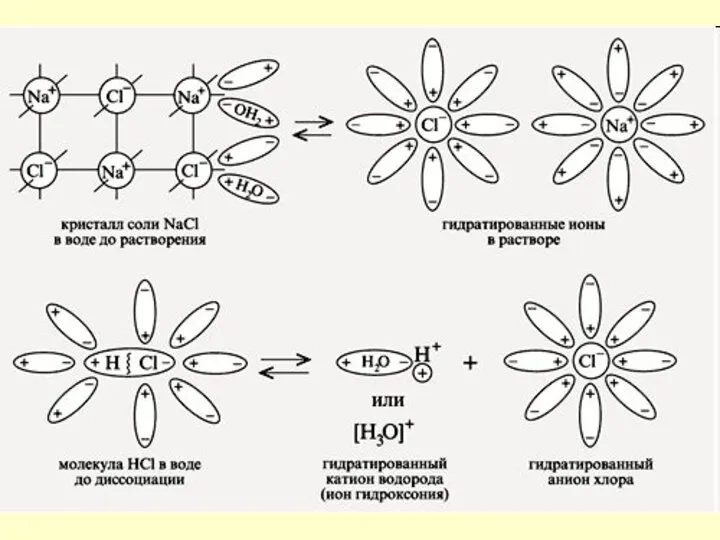
- 6. Вещества с ионной связью Кристаллическая решетка NaCl Кристалл NaCl
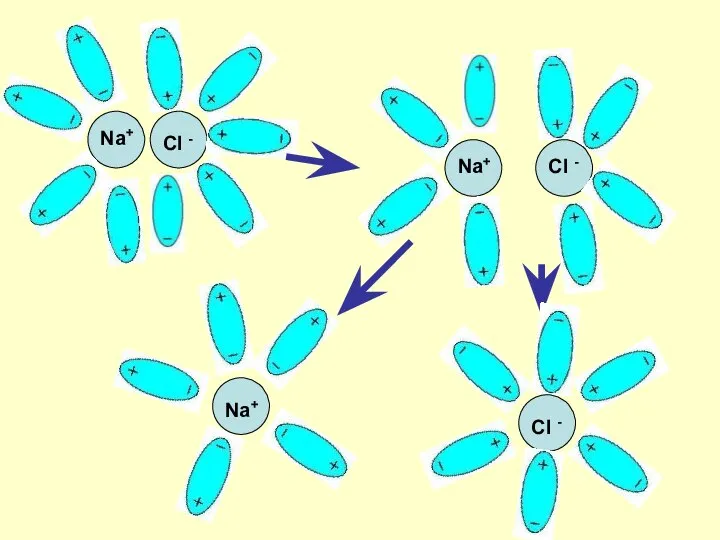
- 7. Механизм ЭД ионных веществ Ориентация диполей воды вокруг кристаллов соли. Образование между молекулами воды и ионами
- 8. Na+ Cl - Na+ Cl - Na+ Cl -
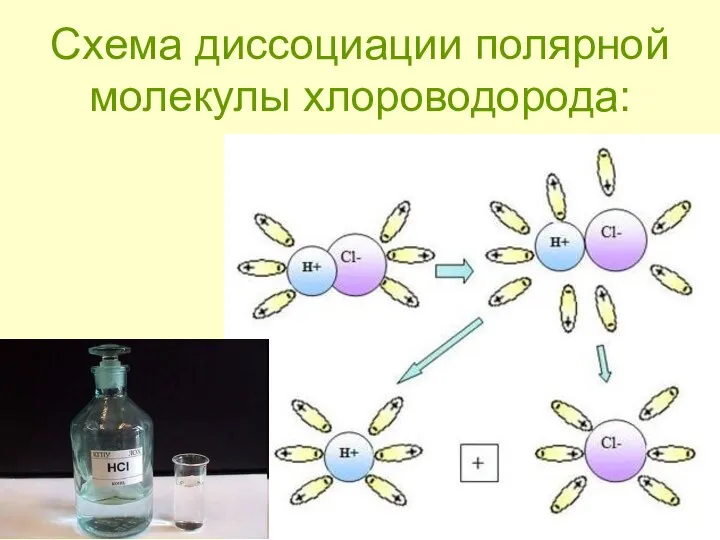
- 9. Механизм ЭД полярных веществ ориентация диполей воды вокруг полярной молекулы. еще большая поляризация полярной молекулы и
- 10. Схема диссоциации полярной молекулы хлороводорода:
- 11. Электролиты Сильные - при растворении в воде практически полностью распадаются на ионы. Слабые частично распадаются на
- 12. Сильные электролиты вещества с ионными или сильно полярными связями. все хорошо растворимые соли, сильные кислоты (HCl,
- 13. Слабые электролиты вещества с неполярными и малополярными связями: 1) почти все органические кислоты (CH3COOH, C2H5COOH и
- 14. Степень диссоциации Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу
- 15. Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. CaCl2 = Ca2+ +
- 16. Диссоциация кислот осуществляется ступенчато. На каждой ступени отщепляется один ион водорода. H Cl = H+ +
- 17. Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Основания - при диссоциации
- 18. Диссоциация солей Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну
- 19. Диссоциация солей Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода,
- 20. Шведский ученый Сванте Аррениус(1859-1927) В 1887 году создал теорию ЭД. В 1903году был удостоен Нобелевской премии
- 21. Каблуков И.А. Кистяковский В.А.
- 22. Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали,
- 23. Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно
- 25. Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным:
- 26. Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией)
- 27. 4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает
- 28. Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов.
- 29. Источники информации: http://slovari.yandex.ru/ http://www.lyceum8.ru/himiya/4.htm http://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.html http://him.1september.ru/2003/34/7.htm http://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
- 31. Скачать презентацию

























 Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов
Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Основные законы химии
Основные законы химии Ацетилен
Ацетилен Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Декарбонизаторы. Декарбонизация
Декарбонизаторы. Декарбонизация Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Проблемное обучение на уроках химии
Проблемное обучение на уроках химии Галогены. Их значение в жизни человека
Галогены. Их значение в жизни человека Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Компетентностный подход в обучении химии "Плохой учитель преподносит истину, хороший учит ее находить» А. Дист
Компетентностный подход в обучении химии "Плохой учитель преподносит истину, хороший учит ее находить» А. Дист Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Строение электронных оболочек атомов. Электроны в атоме
Строение электронных оболочек атомов. Электроны в атоме Классификация органических соединений
Классификация органических соединений 6efbceb9eca3e929
6efbceb9eca3e929 Физические свойства металлов
Физические свойства металлов Спирты. Строение
Спирты. Строение Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Кислоты
Кислоты Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Ароматические нитросоединения
Ароматические нитросоединения Свойства нефти
Свойства нефти Массовая доля растворённого вещества
Массовая доля растворённого вещества