Содержание
- 2. Химические реакции могут протекать с различной скоростью. Одни реакции идут быстро. К ним относятся, например, реакции
- 4. Факторы, влияющие на скорость реакции Скорость химической реакции зависит от большого числа факторов: концентрации реагентов, их
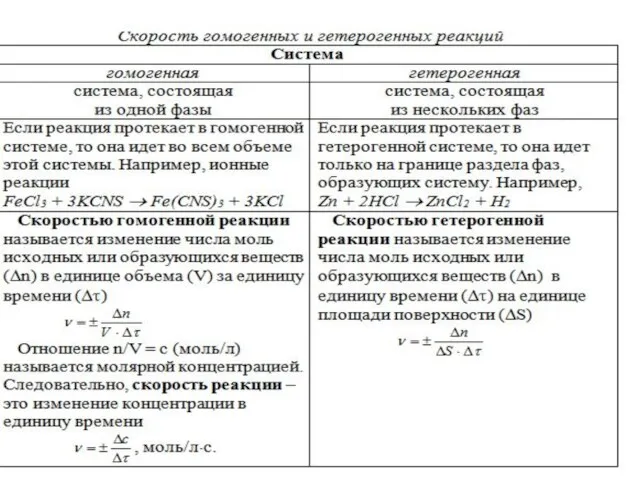
- 5. Влияние концентрации реагентов на скорость реакции Необходимым условием того, чтобы между частицами исходных веществ произошло химическое
- 6. Это соотношение выражает закон действующих масс, открытый опытным путем норвежскими учеными К. Гульдбергом и П. Вааге
- 7. Формулировка закона действующих масс: При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ,
- 8. Физический смысл константы скорости химической реакции: она численно равна скорости реакции при концентрациях реагирующих веществ, равных
- 9. В случае гетерогенных реакция в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся
- 10. Молекулярность реакции Молекулярностью реакции называется число молекул реагентов, участвующих в простой реакции, состоящей из одного молекулярного
- 11. Тримолекулярные реакции встречаются очень редко, т.к. вероятность одновременного столкновения трех молекул невелика. Примеры таких реакций
- 12. Порядок реакции Порядок реакции определяется по кинетическому уравнению реакции и равен сумме показателей степеней при концентрациях
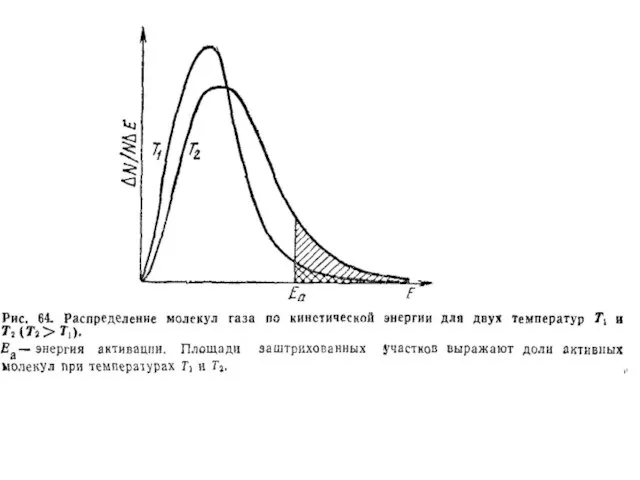
- 13. Влияние температуры на скорость реакции Скорость химических реакций в большинстве случаев с нагреванием возрастает. Так, на
- 14. Математически эта зависимость выражается следующим уравнением: где: γ - температурный коэффициент скорости реакции, показывающий, во сколько
- 15. По кинетической теории газов число столкновений при повышении температуры, например, от 0 до 1000С возрастает в
- 17. Зависимость скорости реакции от температуры выражается уравнением Аррениуса (1889 г.): где k - константа скорости реакции
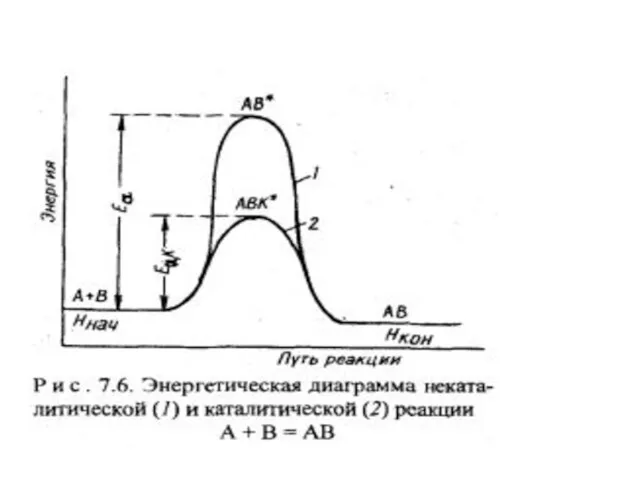
- 18. Влияние катализатора на скорость реакции Катализатор – это вещество, которое резко увеличивает скорость реакции, или вызывает
- 20. Основные черты каталитических процессов 1. Между количествами реагентов и катализатора существует огромная диспропорция. Так, одна весовая
- 21. 2. Катализаторы отличаются селективностью (избирательностью). Например, на оксиде алюминия Al2O3 при 350 0С происходит дегидратация этилового
- 22. 3. Присутствие в зоне реакции посторонних веществ по-разному действует на катализатор. Одни нейтральны, другие усиливают действие
- 23. 4. Иногда требуется не ускорить, а замедлить скорость протекания какого-либо процесса. Тогда говорят об отрицательном катализе
- 24. Механизм действия катализатора Действие катализатора связано с тем. что он вступает в промежуточное взаимодействие с реагирующими
- 26. Обратимые реакции. Химическое равновесие Обратимыми называются реакции, которые могут протекать как в прямом, так и в
- 27. Химическим равновесием называется такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции: В
- 29. Факторы, влияющие на химическое равновесие. Принцип Ле Шателье Химическое равновесие, которое устанавливается при равенстве скоростей прямой
- 30. Принцип Ле Шателье: Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то равновесие сместится в
- 31. Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта. Степень смещения равновесия определяется величиной
- 32. Влияние концентраций реагирующих веществ на смещение равновесия По принципу Ле Шателье: Введение в равновесную систему дополнительного
- 34. Скачать презентацию




























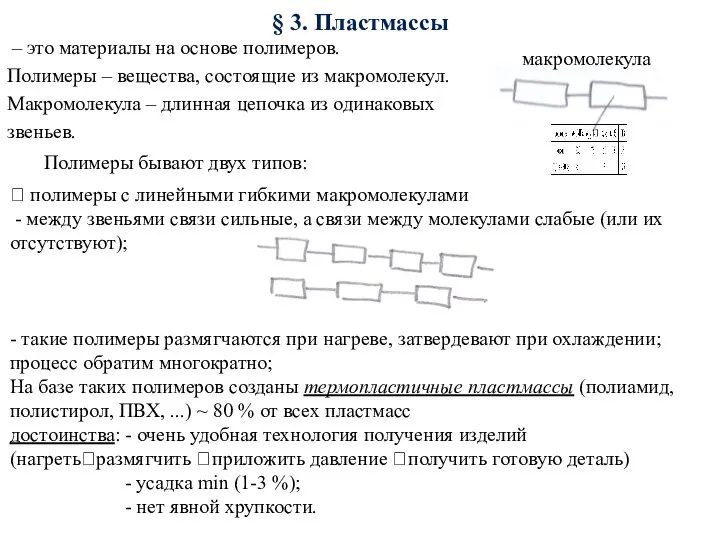 Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ;
KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ; Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химия элементов
Химия элементов Окислительно-восстановительные реакции (1)
Окислительно-восстановительные реакции (1) Явление аллотропии
Явление аллотропии Реакция нейтрализации
Реакция нейтрализации Формы записи химического потенциала в различных фазах
Формы записи химического потенциала в различных фазах Алкины
Алкины Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Реакции ионного обмена составление ионных уравнений
Реакции ионного обмена составление ионных уравнений Железо и его соединения
Железо и его соединения Вспоминаем химию
Вспоминаем химию Термодинамика и теплопередача. Влажный воздух
Термодинамика и теплопередача. Влажный воздух Презентация на тему Неметаллы. Мышьяк
Презентация на тему Неметаллы. Мышьяк  Химия в еде
Химия в еде Презентация на тему Химические свойства кислот
Презентация на тему Химические свойства кислот  Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Физические свойства металлов
Физические свойства металлов Электролитическая диссоциация
Электролитическая диссоциация Непредельные углеводороды (алкены)
Непредельные углеводороды (алкены) Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Диэлектрики
Диэлектрики Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Кроссворд первоначальные понятия
Кроссворд первоначальные понятия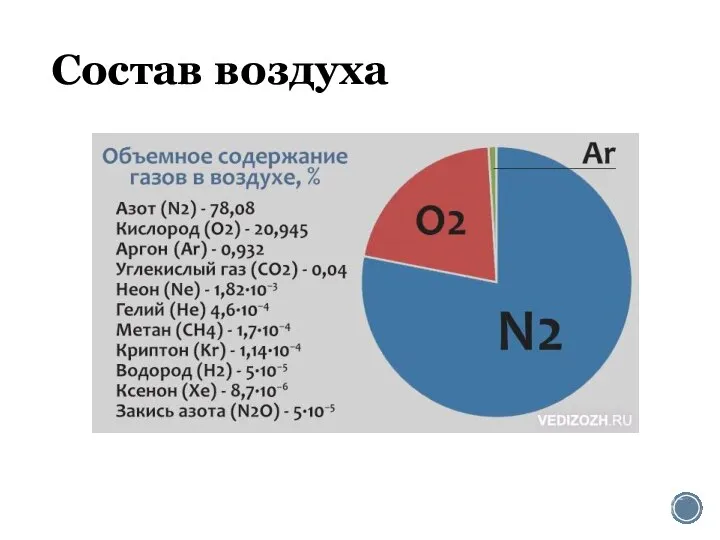 Состав воздуха. Азот
Состав воздуха. Азот Круговорот серы в природе
Круговорот серы в природе Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов