Содержание
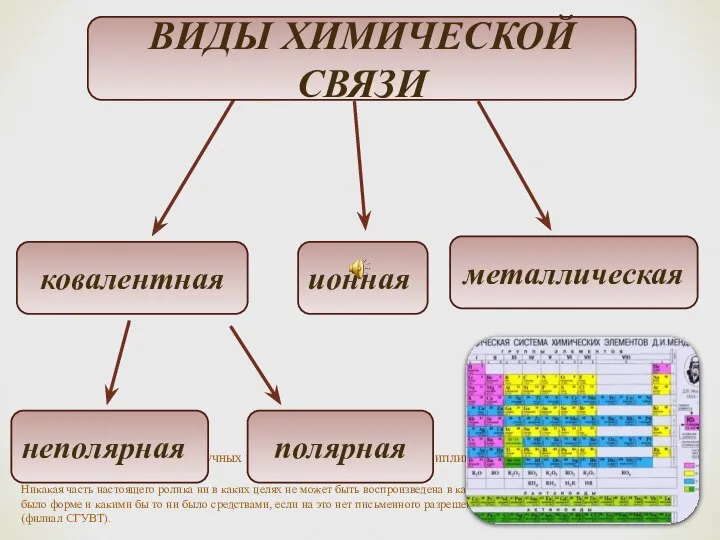
- 2. Химическая связь возникает при взаимодействии двух или более атомов. Взаимодействие атомов осуществляется согласно валентности. Термин «валентность»
- 3. 2021. Кафедра «Естественнонаучных и общепрофессиональных дисциплин» ОИВТ. Все права защищены. Никакая часть настоящего ролика ни в
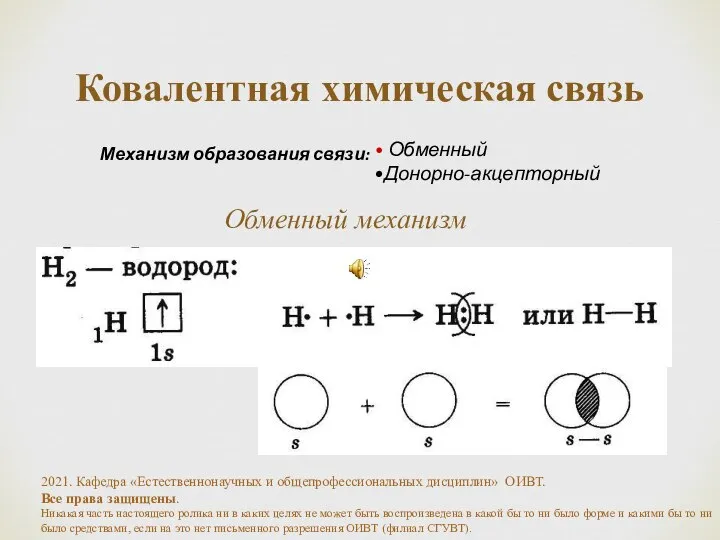
- 4. Ковалентная связь химическая связь, возникающая за счет образования общей пары электронов. Необходимое условие - наличие неспаренных
- 5. Ковалентная химическая связь Обменный Донорно-акцепторный Механизм образования связи: Обменный механизм 2021. Кафедра «Естественнонаучных и общепрофессиональных дисциплин»
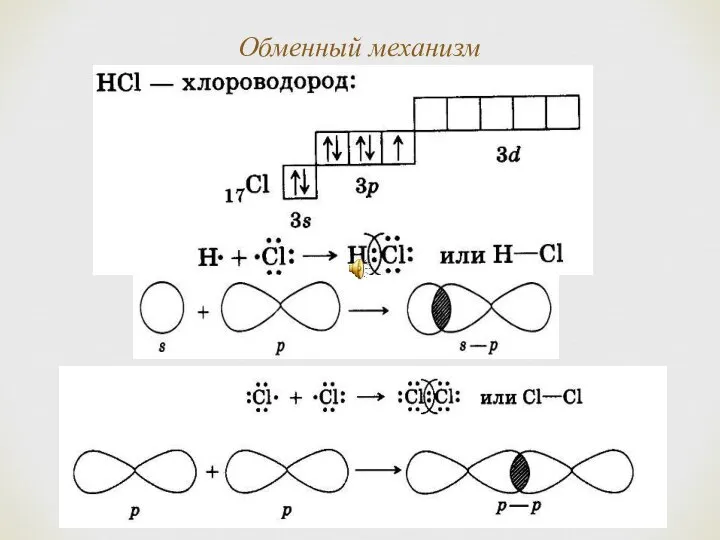
- 6. Обменный механизм
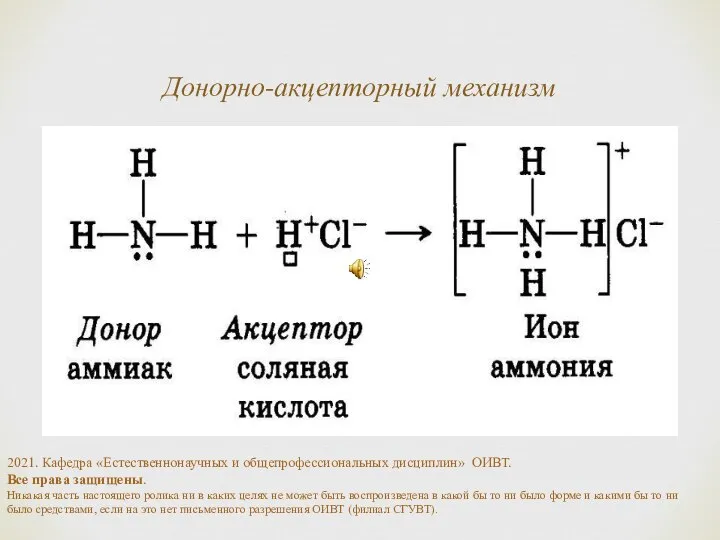
- 7. Донорно-акцепторный механизм 2021. Кафедра «Естественнонаучных и общепрофессиональных дисциплин» ОИВТ. Все права защищены. Никакая часть настоящего ролика
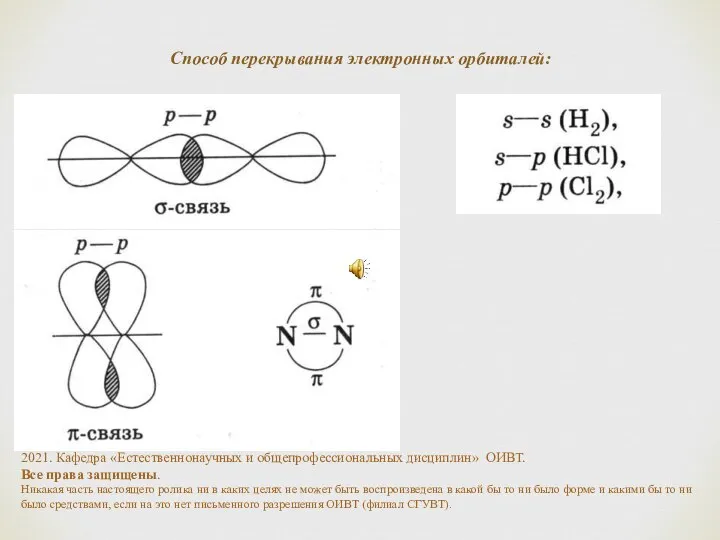
- 8. Способ перекрывания электронных орбиталей: 2021. Кафедра «Естественнонаучных и общепрофессиональных дисциплин» ОИВТ. Все права защищены. Никакая часть
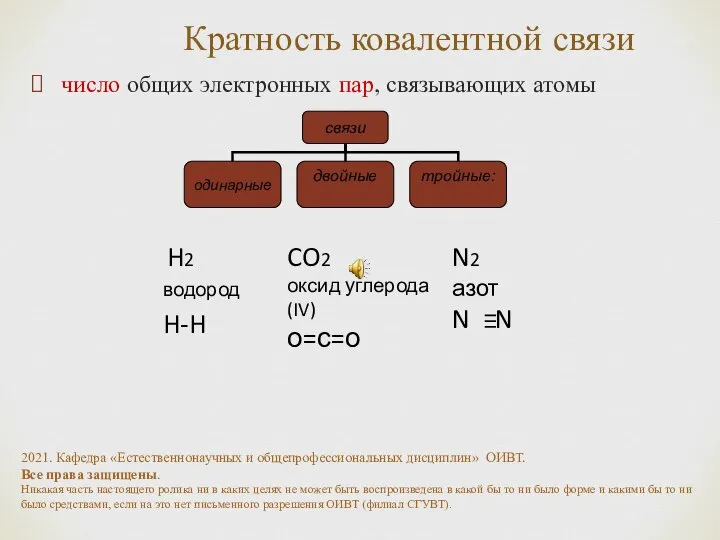
- 9. Кратность ковалентной связи число общих электронных пар, связывающих атомы CO2 оксид углерода (IV) о=с=о N2 азот
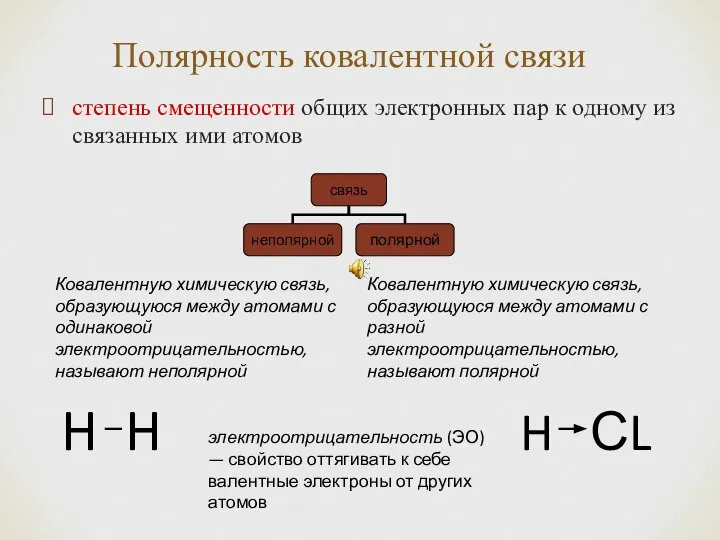
- 10. Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов электроотрицательность (ЭО)
- 11. Чем более электроотрицателен атом, тем сильнее он оттягивает электронную пару, тем более полярна связь (HCl, HF).
- 12. В полярной молекуле HCl электронная пара смещена в сторону атома хлора, и на атоме хлора избыток
- 13. Если в молекуле имеются полярные связи, но векторы дипольных моментов равны по абсолютной величине и противоположны
- 14. Полярность молекул определяется их составом и геометрической формой. Неполярными будут: а) молекулы простых веществ, так как
- 15. Например, молекулы СО2, BF3 и СН4 имеют следующие направления равных (по длине) векторов связей: 2021. Кафедра
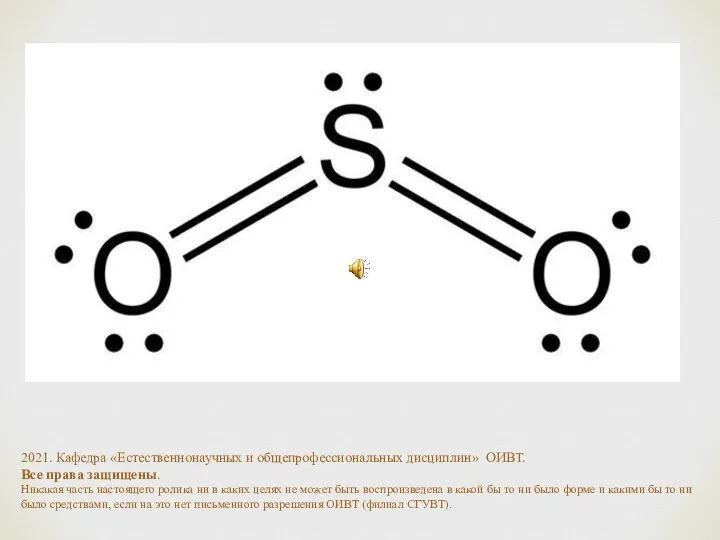
- 16. В то же время молекулы SO2, H2O нелинейны. Например, S имеет 6 электронов на внешнем слое,
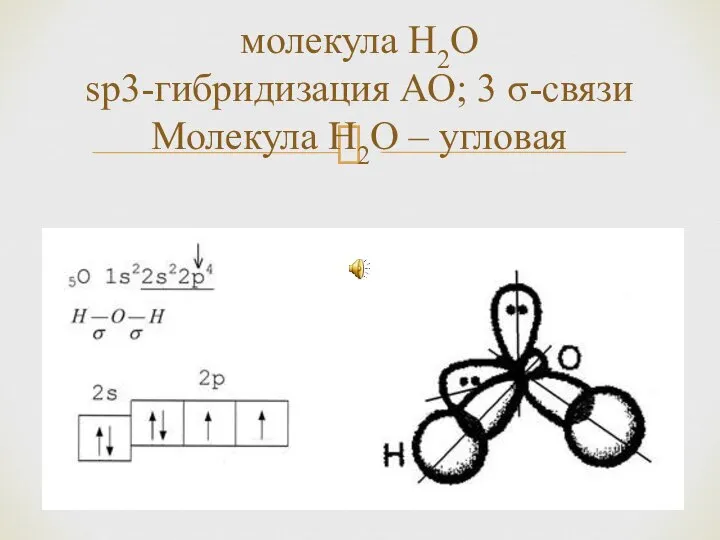
- 17. молекула H2O sp3-гибридизация АО; 3 σ-связи Молекула H2O – угловая
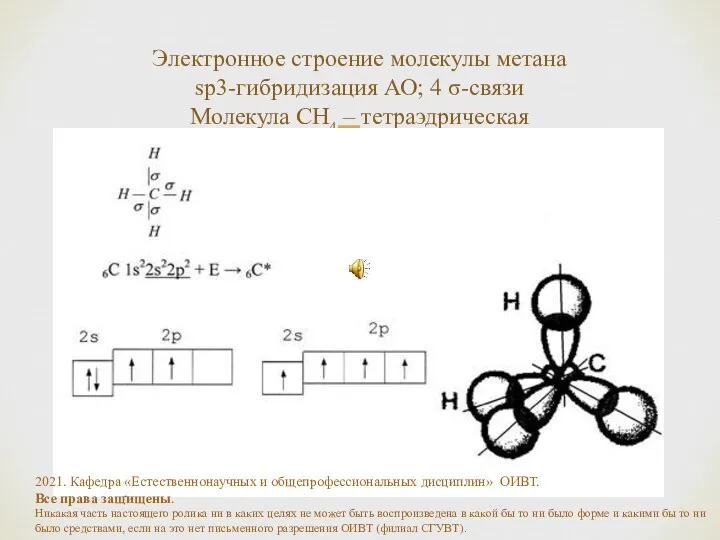
- 18. Электронное строение молекулы метана sp3-гибридизация АО; 4 σ-связи Молекула СH4 – тетраэдрическая 2021. Кафедра «Естественнонаучных и
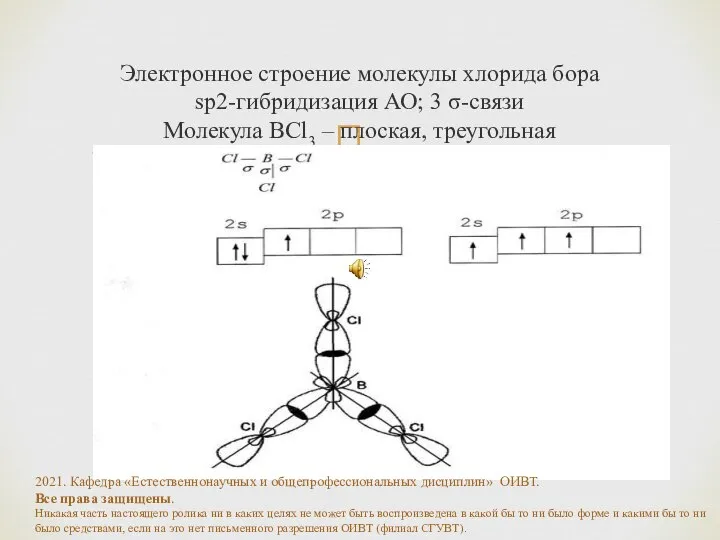
- 19. Электронное строение молекулы хлорида бора sp2-гибридизация АО; 3 σ-связи Молекула BCl3 – плоская, треугольная 2021. Кафедра
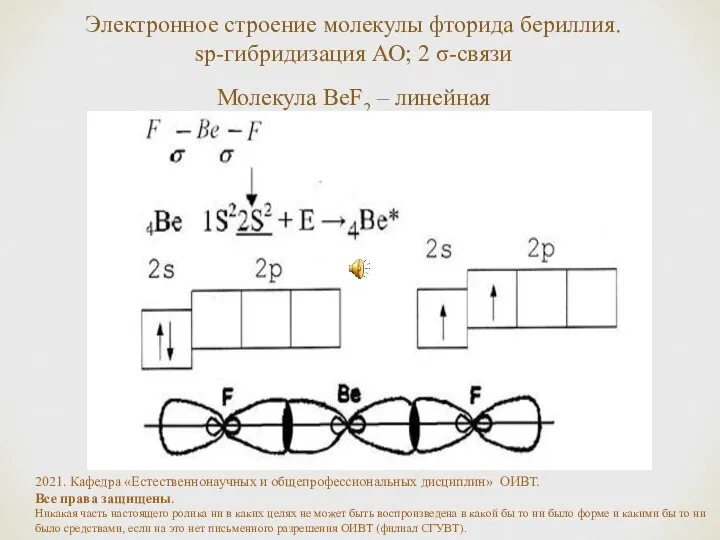
- 20. Электронное строение молекулы фторида бериллия. sp-гибридизация АО; 2 σ-связи Молекула BeF2 – линейная 2021. Кафедра «Естественнонаучных
- 21. 2021. Кафедра «Естественнонаучных и общепрофессиональных дисциплин» ОИВТ. Все права защищены. Никакая часть настоящего ролика ни в
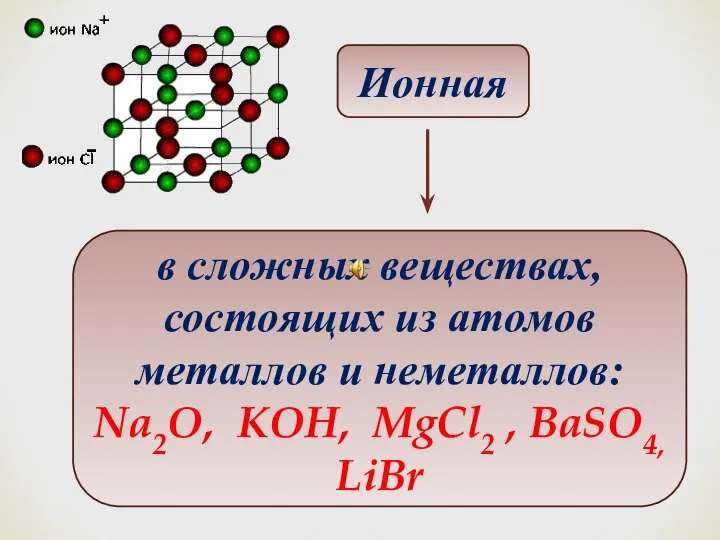
- 23. Ионная связь представляет собой электростатическую силу притяжения между ионами с зарядами противоположного знака (т.е. + и
- 24. Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам 2021. Кафедра «Естественнонаучных
- 25. Ионная связь Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов Ионные соединения состоят из огромного
- 26. Ионная в сложных веществах, состоящих из атомов металлов и неметаллов: Na2O, KOH, MgCl2 , BaSO4, LiBr
- 27. Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества При плавлении и растворении
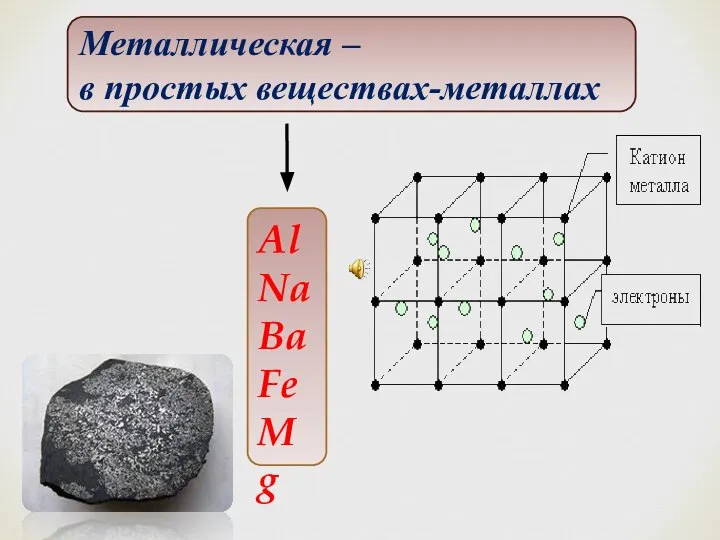
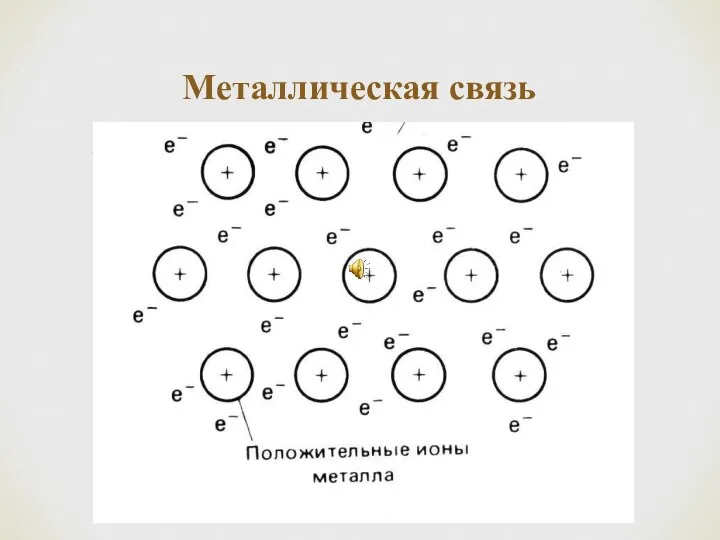
- 29. Металлическая связь В атомах металлов внешние валентные электроны удерживаются значительно слабее, чем в атомах неметаллов. Это
- 30. Al Na Ba Fe Mg Металлическая – в простых веществах-металлах
- 31. Все металлы имеют высокую теплопроводность и высокую электропроводность, которая обеспечивается за счет наличия свободных электронов. Это
- 32. Металлическая связь
- 34. Водородная связь Связь, которая образуется между атомом водорода одной молекулы и атомом сильно электроотрицательного элемента (O,
- 35. Атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород
- 36. Водородная связь Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь,
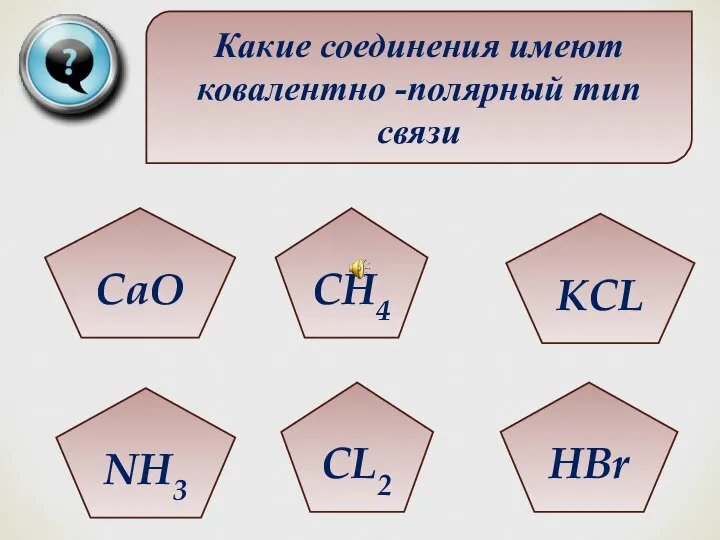
- 37. Какие соединения имеют ковалентно -полярный тип связи CaO NH3 CL2 HBr KCL CH4
- 39. Скачать презентацию




















 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье 9. Потомки светоносного элемента
9. Потомки светоносного элемента Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Химическая связь и ее типы
Химическая связь и ее типы Презентация на тему Вопросы от …
Презентация на тему Вопросы от …  Электролиз
Электролиз Презентация на тему Алмазы Индии
Презентация на тему Алмазы Индии  Ионо-дисперсное состояние микрокомпонентов в растворах
Ионо-дисперсное состояние микрокомпонентов в растворах Синтетические душистые вещества
Синтетические душистые вещества Металлы. Физические свойства металлов
Металлы. Физические свойства металлов Кислота. Карбоновые кислоты
Кислота. Карбоновые кислоты Строение атома
Строение атома Минерал дунит
Минерал дунит Интересные факты о химических элементах
Интересные факты о химических элементах Алкины
Алкины Влияние спиртов на организм человека
Влияние спиртов на организм человека Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Основные классы неорганических соединений. Лекция №3
Основные классы неорганических соединений. Лекция №3 Оксиды, их классификация и химические свойства. 8 класс
Оксиды, их классификация и химические свойства. 8 класс Презентация на тему Ковалентная химическая связь
Презентация на тему Ковалентная химическая связь  Аналитическая химия. Гомогенные растворы
Аналитическая химия. Гомогенные растворы химия
химия Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  Природные источники углеводородов. Нефть. Нахождение в природе,состав и физические свойства
Природные источники углеводородов. Нефть. Нахождение в природе,состав и физические свойства Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Классификация неорганических веществ
Классификация неорганических веществ Химия спирты одноатомные предельные
Химия спирты одноатомные предельные Основания и их свойства
Основания и их свойства