Слайд 2Процесс распада электролитов на ионы в водном растворе или расплаве называется электролитической

диссоциацией.
Положительные ионы называют катионами,
отрицательные ионы – анионами.
К катионам относятся: ион водорода и ионы металлов, катионы основных солей.
К анионам относятся: гидроксид-ион, ионы кислотных остатков, анионы кислых солей.
Слайд 3ДИССОЦИАЦИЯ КИСЛОТ:
H2SO4 → 2H+ + SO42-
HCl → H+ + Cl-
HNO3 → H+

+ NO32-
Слайд 4ДИССОЦИАЦИЯ ОСНОВАНИЙ:
NaOH → Na+ + OH-;
Ca(OH)2 → Ca2+ + 2OH-;

Слайд 5Диссоциация растворимых солей:
NaCI Na+ + CI-
AI2(SO4)3 2AI3+ + 3SO42-

Слайд 6ДИССОЦИАЦИЯ ВОДЫ:
Н2О → Н+ + ОН –
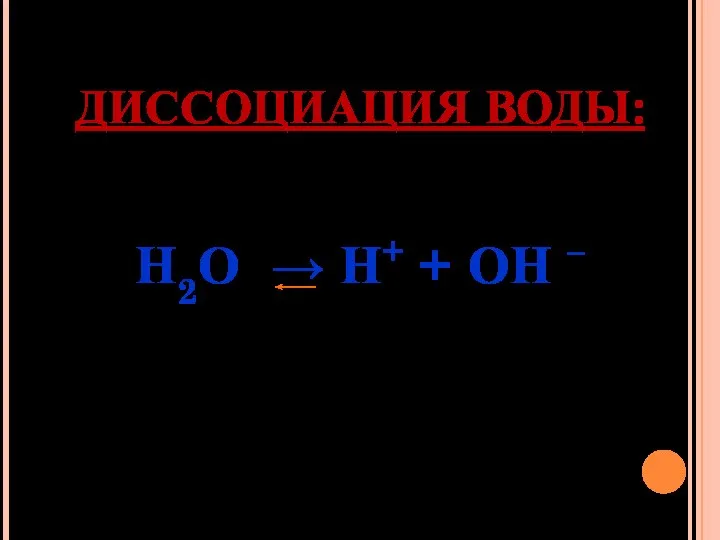
Слайд 7В чистой воде соотношение ионов водорода и гидроксид-ионов равное:
Н+ = ОН-
среда

нейтральная;
При добавлении кислоты равновесие нарушается:
Н+ > ОН-
среда раствора кислая;
При добавлении щёлочи:
Н+ < ОН-
среда раствора щелочная.
Слайд 8ГИДРОЛИЗ СОЛЕЙ
Гидролиз солей

Слайд 9ГИДРОЛИЗ -
от греч. «гидро» - вода,
«лизис» - разложение.

Слайд 10ГИДРОЛИЗ СОЛЕЙ –
реакция обмена между солью и водой,
приводящая к образованию

слабого
электролита.
Слайд 114 ТИПА СОЛЕЙ:
соль, образованная
сильной кислотой и слабым основанием (ALCl3);
сильным основанием и

слабой кислотой (Na2 S);
сильным основанием и сильной кислотой (NaCl);
слабым основанием и слабой кислотой (СН3СООNH4).
Слайд 12:
Соль, образованная сильной кислотой и слабым основанием.
AlCl3 → Al3+ + 3Cl-;
Н2О →

Н+ + ОН –;
Al3+ + Н+ + ОН – → AlОН2+ + Н+;
в растворе в свободном виде остался ион водорода (Н+), значит среда раствора кислая;
полное уравнение гидролиза:
AlCl3 + Н2О → AlОНCl2 + НCl;
Слайд 13Соль, образованная, сильным основанием и слабой кислотой.
Na2S 2Na++S2-
Н2О → Н+

+ ОН –;
S2- + H2O HS- + OH-
в растворе в свободном виде остался гидроксид ион ( OH-), значит среда раствора щелочная.
Полное уравнение гидролиза
Na2S + H2O NaHS + NaOH
Слайд 14Соль, образованная сильным основанием и сильной кислотой
КСl + Н2О ↔

КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.
Слайд 15Соль, образованная слабым основанием и сильной кислотой.
CH3COONH4 CH3COO- +NH4+
Н2О → Н+

+ ОН –;
CH3COO- + NH4+ +H2O CH3COOH + NH3*H2O
CH3COONH4 + H2O CH3COOH + NH3*H2O
В этом случае гидролизу подвергаются как катион, так анион, образуются слабые электролиты, и среда раствора оказывается близкой к нейтральной или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.
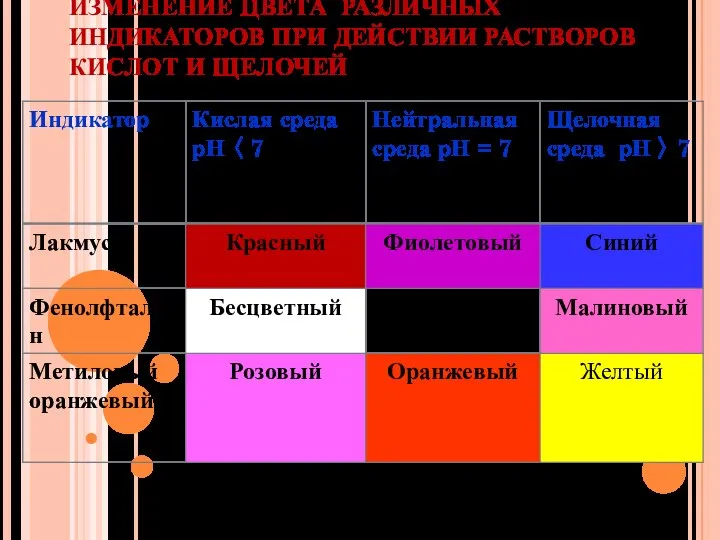
Слайд 16Индикаторы –вещества, которые меняют окраску в зависимости от среды.

Слайд 17ИЗМЕНЕНИЕ ЦВЕТА РАЗЛИЧНЫХ ИНДИКАТОРОВ ПРИ ДЕЙСТВИИ РАСТВОРОВ КИСЛОТ И ЩЕЛОЧЕЙ
Слайд 18Демонстрационный опыт: к раствору соды Na2CO3 приливаем поочерёдно индикаторы лакмус и метилоранж,

Слайд 19
Вывод:
раствор соли, образованной слабым основанием и сильной кислотой имеет кислую среду.

Слайд 20КАКОЙ ВЫВОД МОЖНО СДЕЛАТЬ, ИСХОДЯ ИЗ СОСТАВА СОЛИ И СРЕДОЙ ЕЁ РАСТВОРА?
Раствор

соли, образованной сильным основанием и слабой кислотой имеет щелочную среду.
Слайд 21Вывод:
Среда нейтральная,т.к. не образуется слабый электролит;
такие соли гидролизу не подвергаются.

Слайд 23СИЛУ УМУ ПРИДАЮТ УПРАЖНЕНИЯ
1.Кислую среду имеет водный раствор:
а.Na3PO4
б.KCl

в.Na2CO3
г. ZnSO4
2.Щелочную среду имеет водный раствор:
а.FeCl3
б.K2SO4
в.Na2CO3
г.BaCl2
Слайд 24 3.Нейтральную среду имеет раствор:
а. Нитрата меди (II) Cu(NO3)2
б.Нитрата

бария BaNO3
в.Ацетата калия CH3COONH4
г.Карбоната натрия Na(CO3)2
4.Одинаковую реакцию среды имеют растворы карбоната натрия и
а.нитрата бария BaNO3
б.сульфита калия K2SO3
в.сульфата натрия Na2SO4
г.хлорида алюминия AICI3
Слайд 25 5.Кислую реакцию среды имеет каждый из двух растворов:
а.BaCl2 и ZnCl2

б.AlCl3 и FeCl2
в.FeCl3 и NaCl
г.KCl и CaCl2
6.Соль, образованная сильным основанием и сильной кислотой,
а.Гидролизуется по катиону
б.Гидролизуется по аниону
в.Не подвергается гидролизу
г.Полностью разлагается водой
Слайд 267. Установите соответствие между составом соли и реакцией среды её водного раствора
Ответ:

Слайд 27 8. Установите соответствие между названием соли и средой её водного раствора.





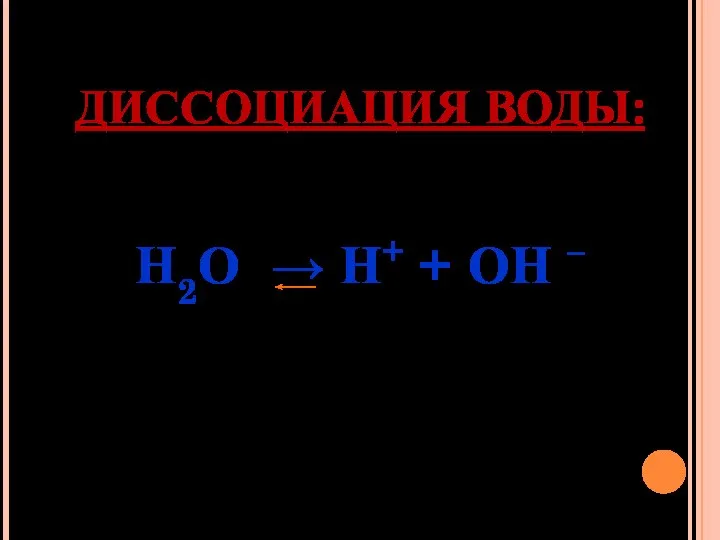




















 Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Химические реакции
Химические реакции Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum
Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum Соли, их классификация и свойства
Соли, их классификация и свойства Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення
Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення Звездный час. Знатоки химии
Звездный час. Знатоки химии Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Кристаллы и минералы
Кристаллы и минералы Первые химические символы
Первые химические символы Кондуктометрический анализ
Кондуктометрический анализ Металлы. Определения
Металлы. Определения Получение металлов в промышленности. Чёрная металлургия
Получение металлов в промышленности. Чёрная металлургия Полипропилен (ПП)
Полипропилен (ПП) Карбоновые кислоты
Карбоновые кислоты Галогеноводородные кислоты
Галогеноводородные кислоты Химические реакции в органике
Химические реакции в органике Химия природная и синтетическая: за и против
Химия природная и синтетическая: за и против Дзержинский политехнический институт. Отчет о работе химической школы
Дзержинский политехнический институт. Отчет о работе химической школы Оксиды. Классификация, химические и физические свойства
Оксиды. Классификация, химические и физические свойства Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Сталь. Свойства стали
Сталь. Свойства стали Водород
Водород