Слайд 2Сложность строения атома
1896 год, А. Беккерель открыл радиоактивность.
1899 – 1903 год, Э.

Резерфорд открыл α-,β- и γ-лучи.
1909 – 1911 год, Э. Резерфорд открыл ядра атомов.
1909 год, Р. Малликен определил заряд электрона.
1911 год, Э. Резерфорд предложил одну из первых теорий строения атома
Слайд 3Модели строения атома
Модель Уильяма Томсона (1902 год)
(«изюм в пудинге»)

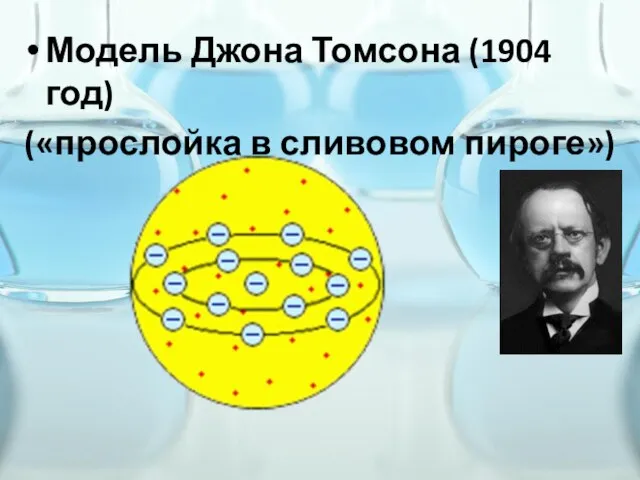
Слайд 4Модель Джона Томсона (1904 год)
(«прослойка в сливовом пироге»)
Слайд 5Модель Филиппа фон Ленарда (1904 год)

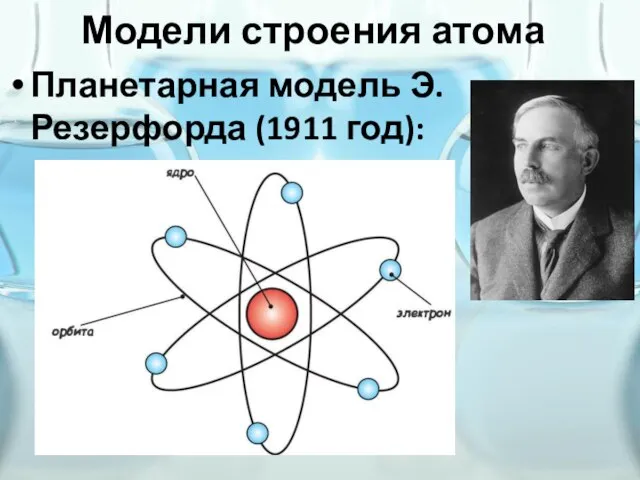
Слайд 6Модели строения атома
Планетарная модель Э. Резерфорда (1911 год):
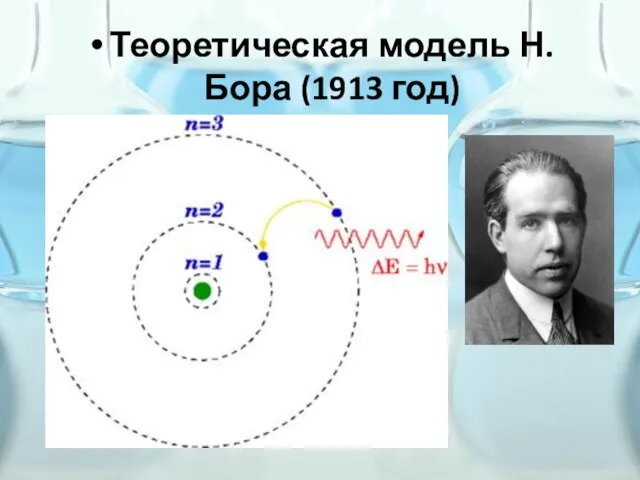
Слайд 7Теоретическая модель Н. Бора (1913 год)
Слайд 8Постулаты Бора
Электрон может вращаться вокруг ядра не по произвольным, а только по

строго определённым (стационарным) круговым орбитам: m·v·r = n·h
При движении по стационарным орбитам электрон не излучает и не поглощает энергии: ΔE = E1 – E2 = h·ν
Слайд 9Квантовая модель (полностью сформулирована после 1932 года)
1. Электрон имеет двойственную природу (масса

и заряд, а также длина волны):
λ = h/m·v (Луи де Бройль)
2. Для электрона невозможно точно измерить координату и скорость:
Δx·m· Δv > h/2 (Вернер Гейзенберг)
Слайд 103. Электрон в атоме не движется по определённым траекториям, а может находиться

в любой части околоядерного пространства.
4. Ядра атомов состоят из протонов и нейтронов (в общем, нуклонов).
Слайд 11Нуклиды
различные виды атомов.
А – массовое число;
Z – заряд ядра;
n – число нейтронов.
Изотопы

– нуклиды с одинаковым Z.
Слайд 12Электронная оболочка
– совокупность всех электронов в атоме.
Электронный слой образуют электроны с близкими

значениями энергии.
Электронное облако (орбиталь) - пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.












 Магний и его сплавы
Магний и его сплавы Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип
Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип Буферные системы
Буферные системы Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Минеральные вещества
Минеральные вещества Предпосылки открытия Периодического закона Д. И. Менделеевым
Предпосылки открытия Периодического закона Д. И. Менделеевым Гидролиз солей
Гидролиз солей Химическая связь. Метод валентных связей
Химическая связь. Метод валентных связей Электролитическая диссоциация (9 класс)
Электролитическая диссоциация (9 класс) Наноматеріали. Тіт Лукрецій Кар
Наноматеріали. Тіт Лукрецій Кар Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Железо как химический элемент
Железо как химический элемент Презентация на тему Переработка нефти
Презентация на тему Переработка нефти  Альдегиды. Строение молекул
Альдегиды. Строение молекул Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Сульфаты (2)
Сульфаты (2) Презентация на тему Алхимики
Презентация на тему Алхимики  Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Решение задач
Решение задач Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева Основания. Номенклатура
Основания. Номенклатура Викторин. Диалог химии и медицины
Викторин. Диалог химии и медицины Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Углеводороды. Общие знания
Углеводороды. Общие знания Значимые личности в химии
Значимые личности в химии Медь и ее сплавы
Медь и ее сплавы Азот. Нахождение в природе
Азот. Нахождение в природе