Содержание
- 2. Сплавы - вещества, полученные сплавлением двух или более компонентов. Вещества, образующие сплав, называются компонентами. В сплавах
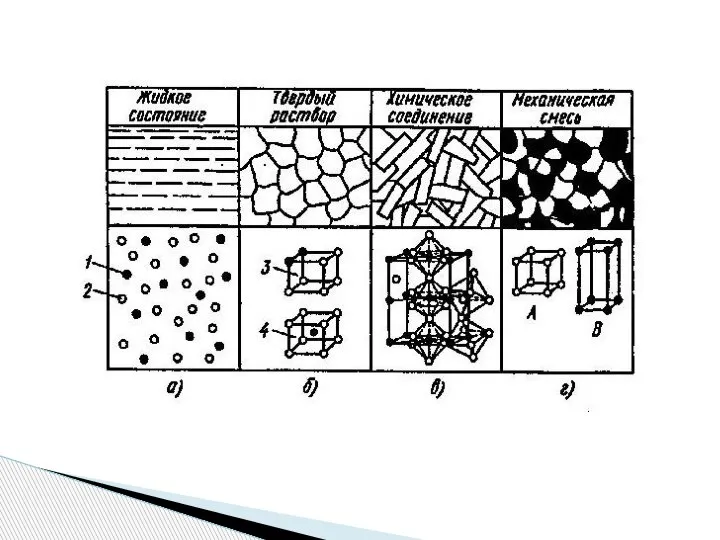
- 3. Классификация и структура сплавов
- 4. Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы
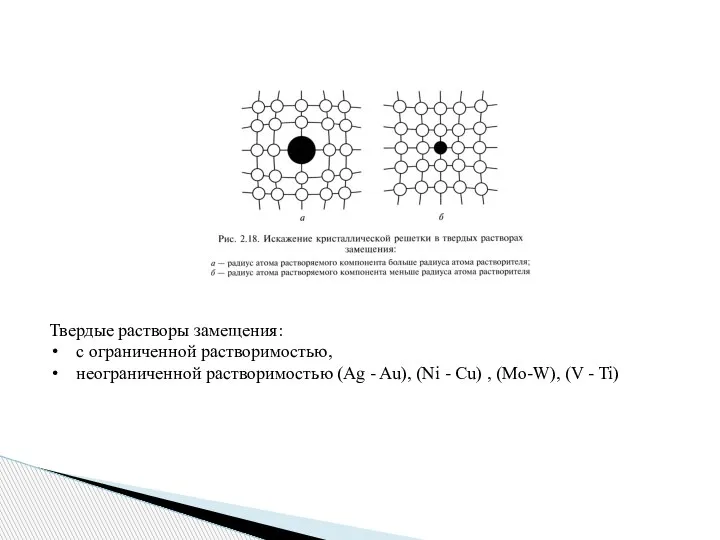
- 5. Твердые растворы замещения: с ограниченной растворимостью, неограниченной растворимостью (Аg - Au), (Ni - Cu) , (Mo-W),
- 6. Для образования неограниченных твердых растворов необходимо: однотипность кристаллических решеток сплавляемых компонентов; близость атомных радиусов компонентов (они
- 7. Характерные особенности: наличие нового типа кристаллической решетки, отличного от типа решеток сплавляемых компонентов; постоянство состава, которое
- 8. Примеры химических соединений: 1. соединения металлов с металлами, так называемые интерметаллиды, например, CuAl2, Ni3Al, 2. соединения
- 9. Механическая смесь двух компонентов А и В образуется, если они не способны к взаимодействию или взаимному
- 11. Общие закономерности сосуществования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом
- 12. Пример: если С = 0, то любое изменение температуры вызывает изменение числа фаз; если С =
- 13. Диаграмма состояния – это графическое изображение состояния сплава в зависимости от температуры и концентрации компонентов. Диаграмма
- 14. В сплавах в зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы , твердые
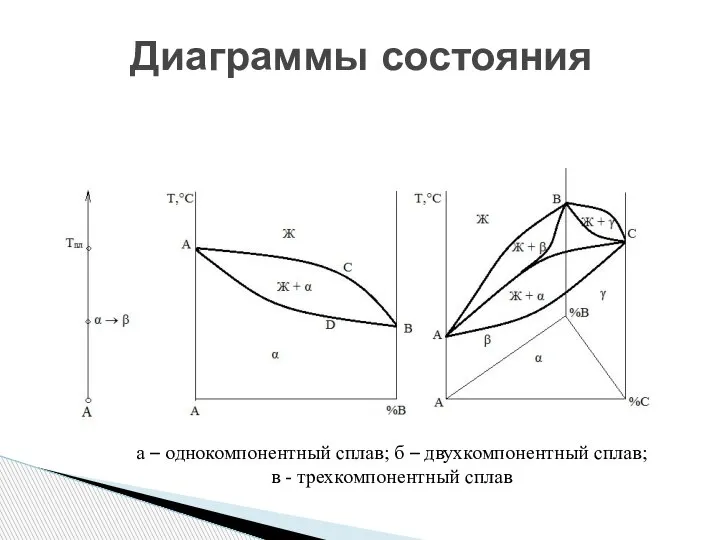
- 15. Диаграммы состояния а – однокомпонентный сплав; б – двухкомпонентный сплав; в - трехкомпонентный сплав
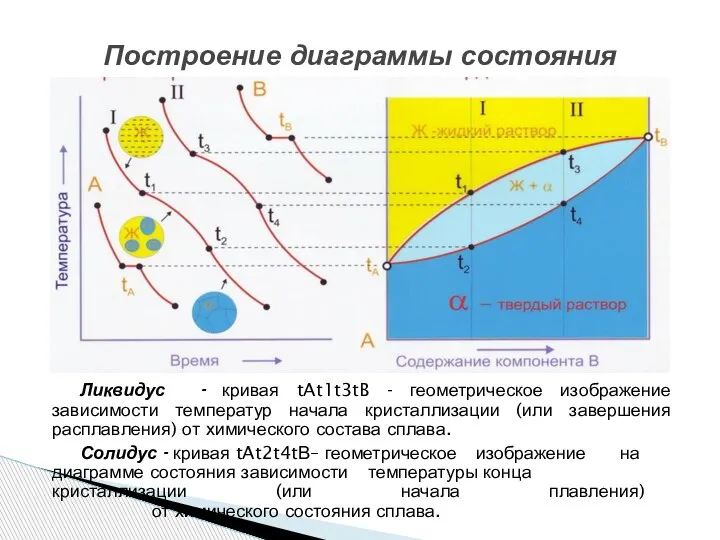
- 16. Построение диаграммы состояния Ликвидус - кривая tAt1t3tB - геометрическое изображение зависимости температур начала кристаллизации (или завершения
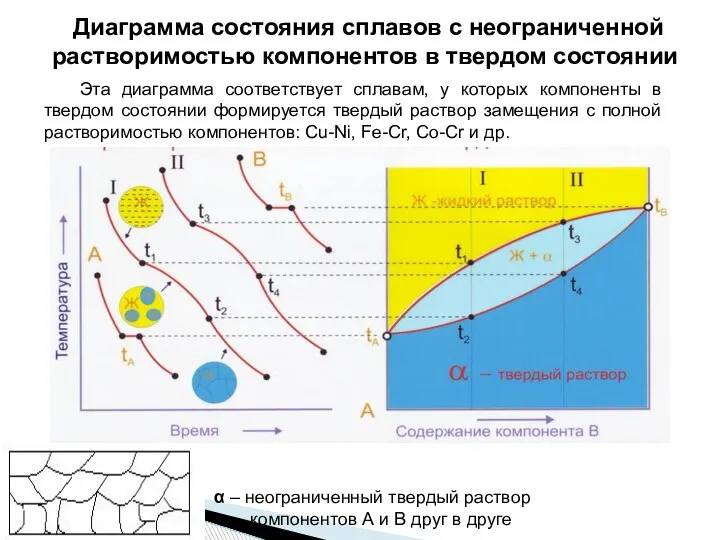
- 17. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии Эта диаграмма соответствует сплавам, у которых
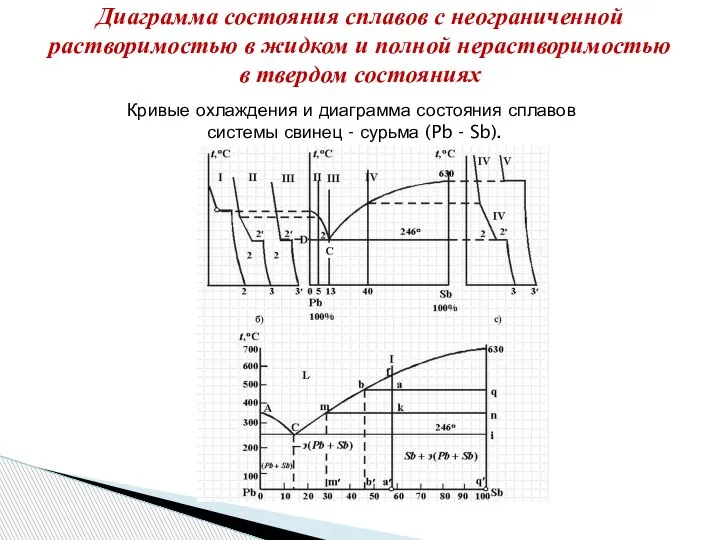
- 18. Диаграмма состояния сплавов с неограниченной растворимостью в жидком и полной нерастворимостью в твердом состояниях Кривые охлаждения
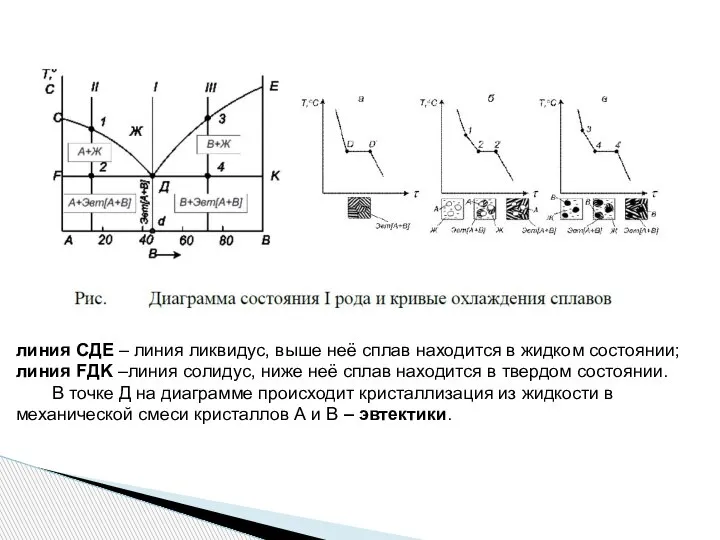
- 19. линия СДЕ – линия ликвидус, выше неё сплав находится в жидком состоянии; линия FДK –линия солидус,
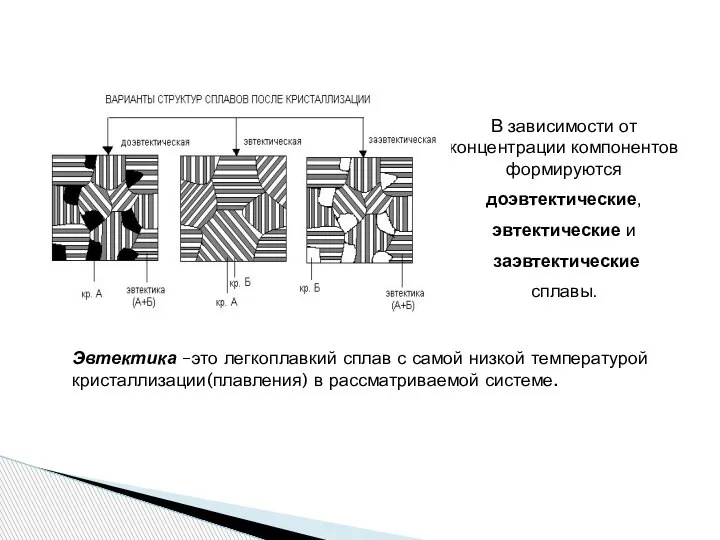
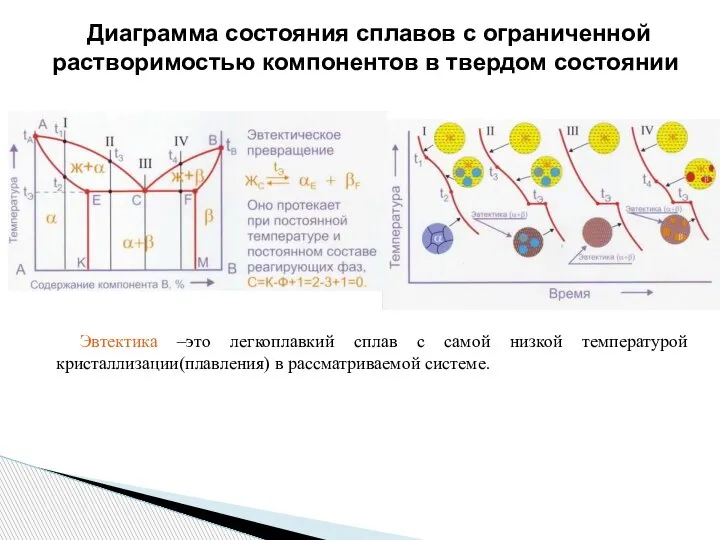
- 20. В зависимости от концентрации компонентов формируются доэвтектические, эвтектические и заэвтектические сплавы. Эвтектика –это легкоплавкий сплав с
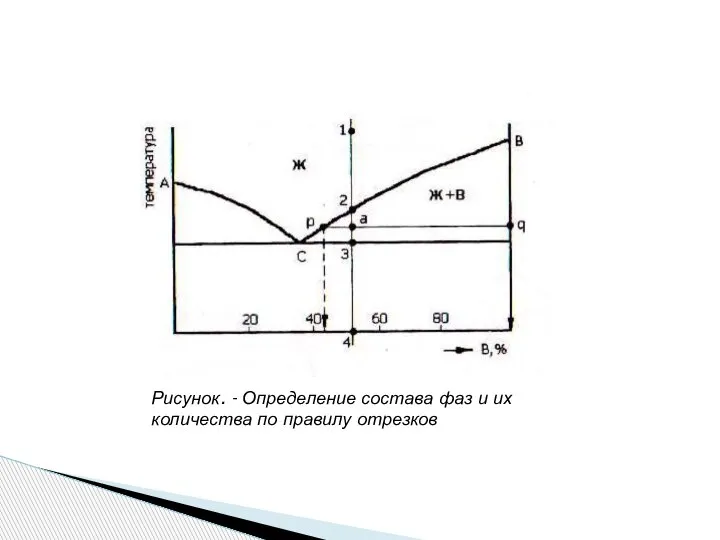
- 21. Правило концентраций устанавливает концентрации фаз при заданной температуре. Через фигуративную точку проводят коноду. Проекция точки пересечения
- 22. Рисунок. - Определение состава фаз и их количества по правилу отрезков
- 23. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии Эвтектика –это легкоплавкий сплав с самой
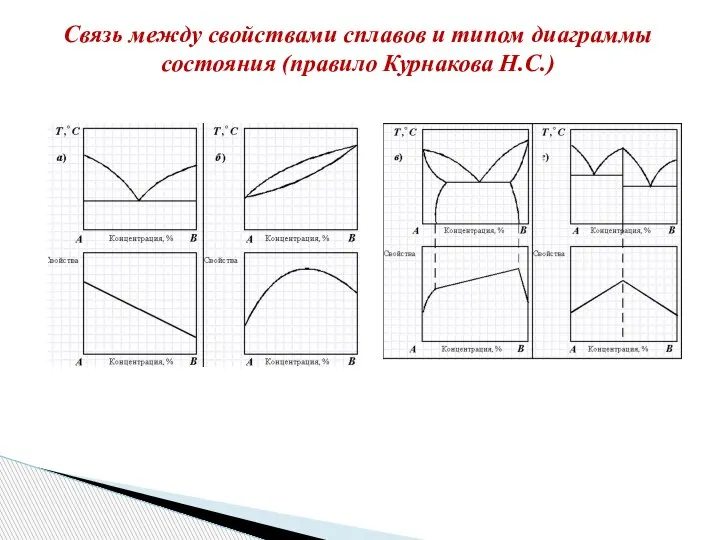
- 24. Связь между свойствами сплавов и типом диаграммы состояния (правило Курнакова Н.С.)
- 25. Неограниченные твердые растворы замещения могут давать только те элементы, атомные диаметры которых отличаются не более чем
- 26. Абсолютно чистое железо (100%) на современном уровне развития техники получить невозможно. Технически чистым считается железо, содержащее
- 27. Железо со многими элементами образует твердые растворы. С углеродом Feα образует твердый раствор внедрения, называемый ферритом.
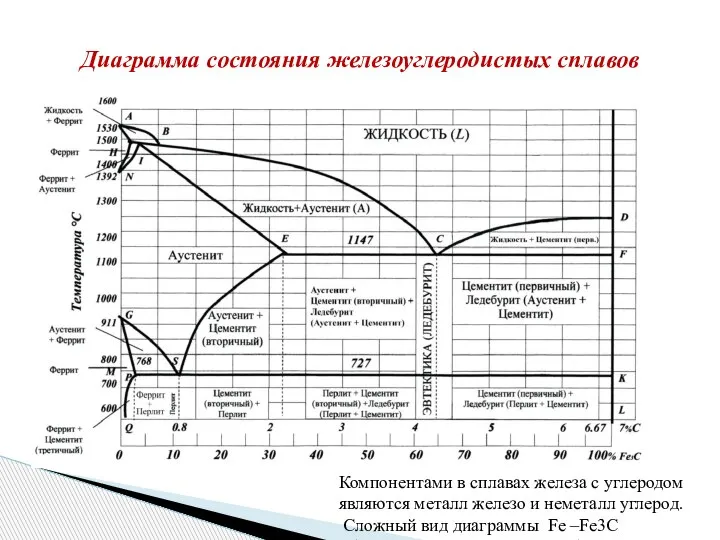
- 28. Химическое соединение железа с углеродом называется цементитом (Fe3C). Цементит содержит 6,67%С и Тпл=1550оС. Цементит - соединение
- 29. Твердые растворы внедрения углерода и других примесей в α-железе называют ферритом, а в γ -железе –
- 30. Смесь кристаллов аустенита и цементита и называется ледебурит Ледебурит - образуется в процессе эвтектического превращения по
- 31. Смеси.
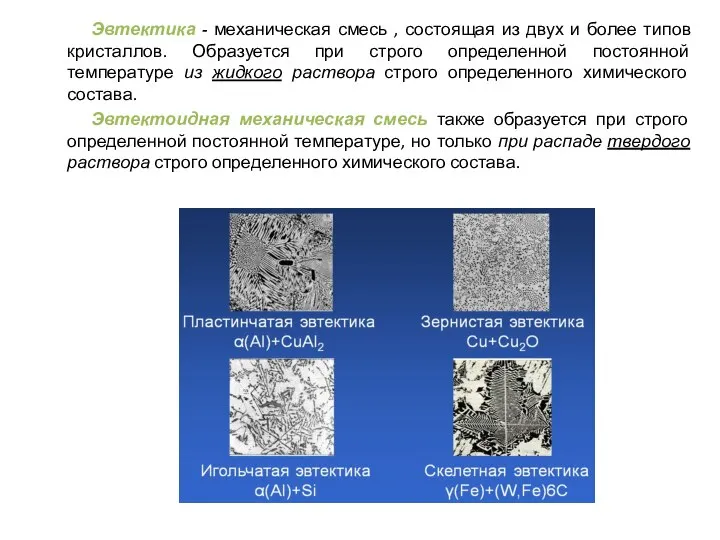
- 32. Эвтектика - механическая смесь , состоящая из двух и более типов кристаллов. Образуется при строго определенной
- 33. Линии диаграммы DC, ES, PQ показывают предельную растворимость углерода соответственно в жидкости, аустените и феррите. Первичный
- 34. Диаграмма состояния железоуглеродистых сплавов Компонентами в сплавах железа с углеродом являются металл железо и неметалл углерод.
- 36. Скачать презентацию




















 Кремний и его соединения
Кремний и его соединения Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Способы очистки питьевой воды
Способы очистки питьевой воды Альдегиды. Общая формула
Альдегиды. Общая формула Валентность
Валентность Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения.
Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения. Экстракция
Экстракция Фотодиссоциация кислорода
Фотодиссоциация кислорода Алкены-3
Алкены-3 Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Сера и ее соединения
Сера и ее соединения Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Химический тренажер
Химический тренажер Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы
Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы Презентация на тему СПИРТЫ (аканолы, алкоголи)
Презентация на тему СПИРТЫ (аканолы, алкоголи)  История развития химии
История развития химии Химические свойства металлов
Химические свойства металлов Порядок констант ССВ JHH в бензоле. Задачи
Порядок констант ССВ JHH в бензоле. Задачи Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Chimie bioorganique
Chimie bioorganique Соли. Свойства. Получение
Соли. Свойства. Получение Самородные минералы
Самородные минералы Peek. Сферы применения
Peek. Сферы применения Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12 Показатели обогащения
Показатели обогащения Поливинилхлорид
Поливинилхлорид Получение и реакции пиразина
Получение и реакции пиразина Башня плотности
Башня плотности