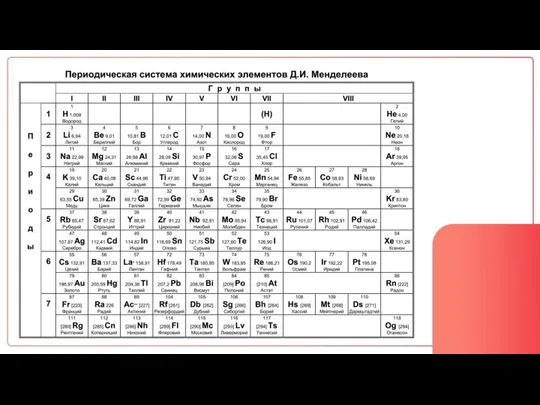
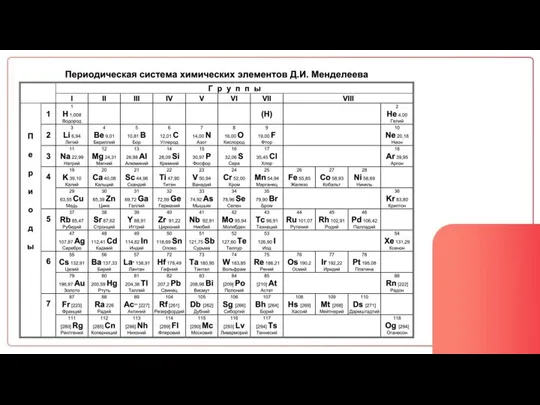
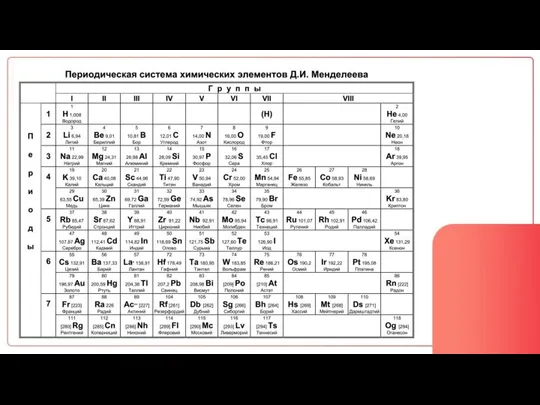
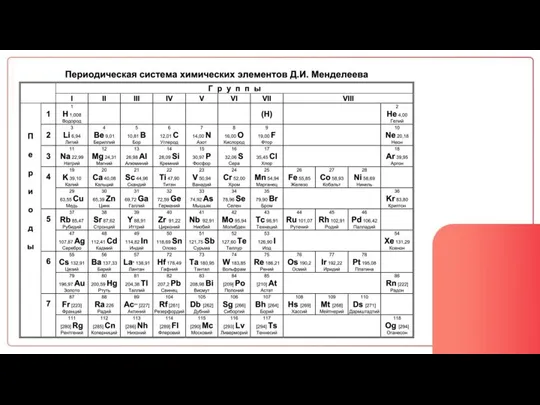
Содержание
- 2. Что такое атом?
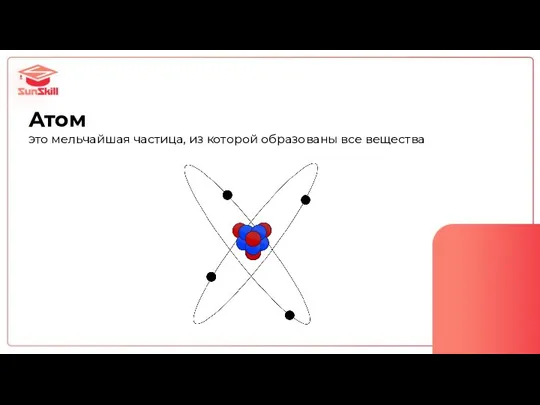
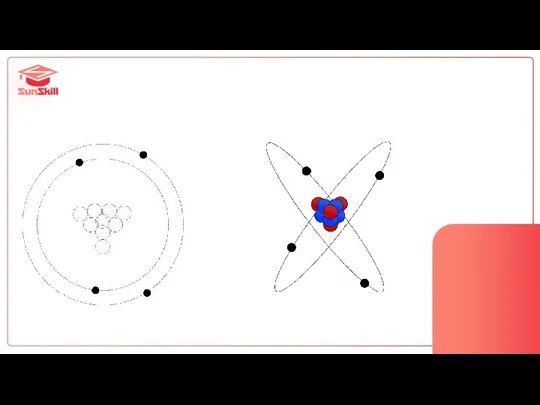
- 3. Атом это мельчайшая частица, из которой образованы все вещества
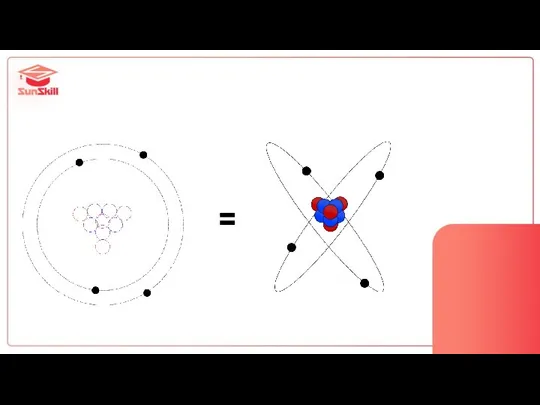
- 4. =
- 5. Из чего состоят атомы?
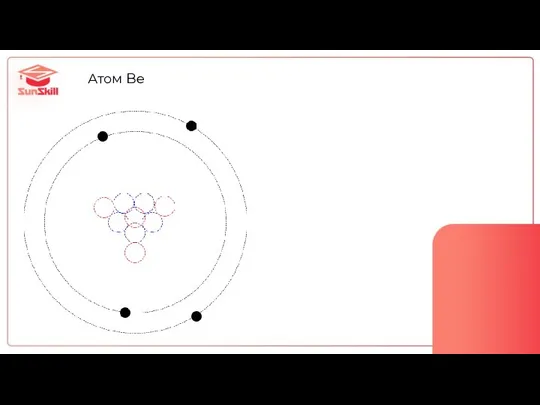
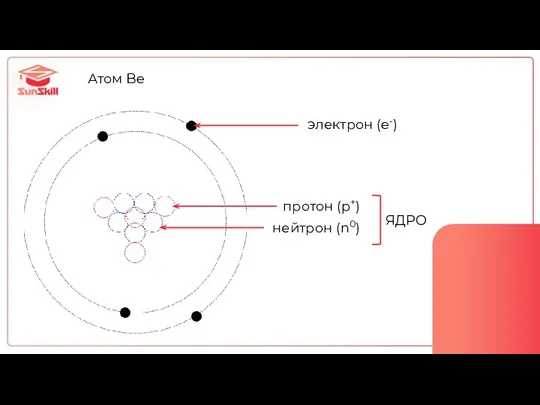
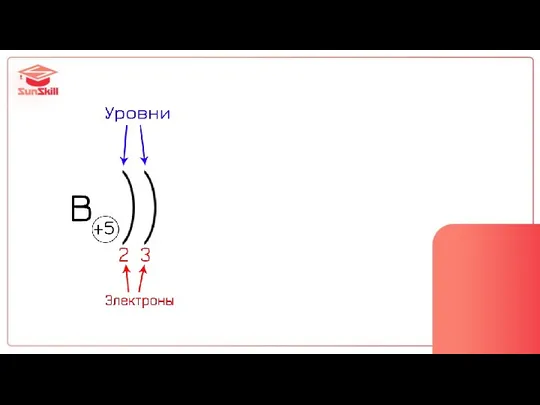
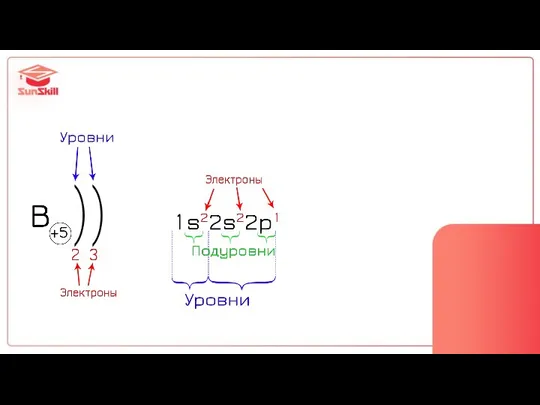
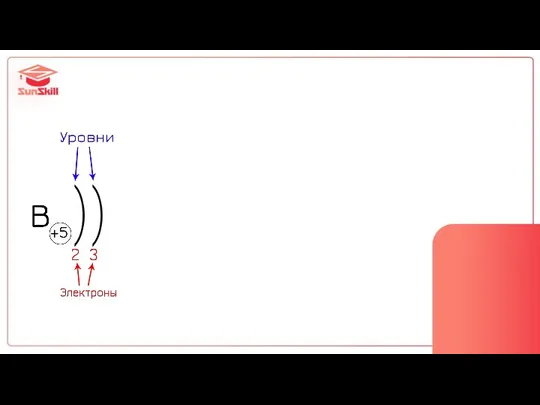
- 6. Атом Be
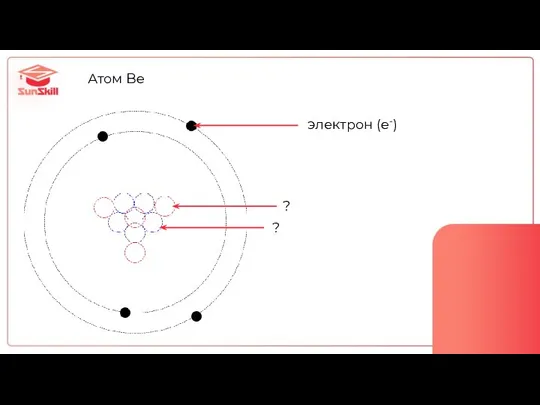
- 7. Атом Be электрон (e-) ? ?
- 8. ПОРЯДКОВЫЙ НОМЕР ПОКАЗЫВАЕТ: Число протонов (p) Число электронов (e) Заряд ядра
- 10. Атом Be электрон (e-) протон (p+) нейтрон (n0) ЯДРО
- 11. Массовое число показывает количество частиц в ядре
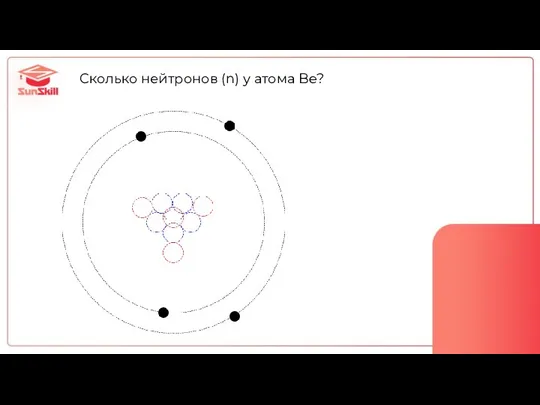
- 12. Сколько нейтронов (n) у атома Be?
- 13. Нейтроны = Массовое число - Протоны
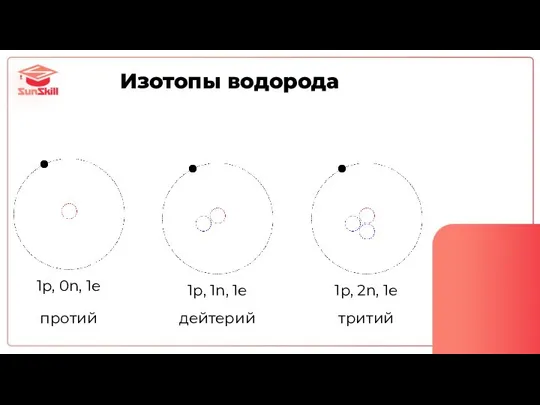
- 14. Кто такие изотопы?
- 15. Изотопы атомы одного элемента, которые имеют разное массовое число (количество нейтронов)
- 16. протий дейтерий тритий 1p, 0n, 1e 1p, 1n, 1e 1p, 2n, 1e Изотопы водорода
- 17. Массовое число протоны + нейтроны Порядковый номер протоны = электроны = заряд ядра
- 18. Электронная оболочка
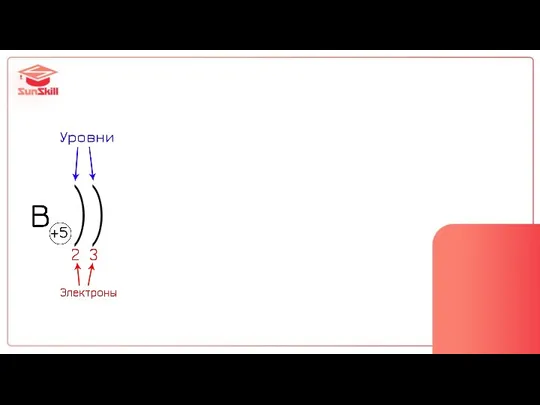
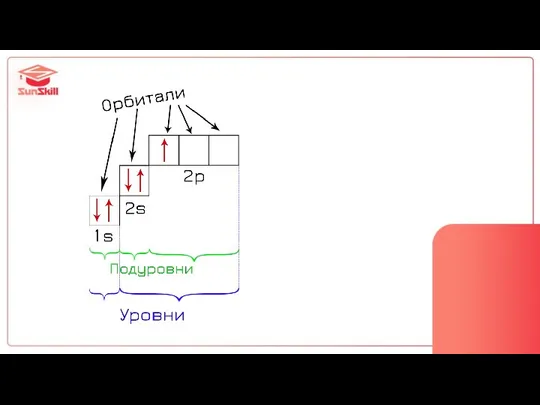
- 19. Электронная оболочка совокупность всех электронов атома
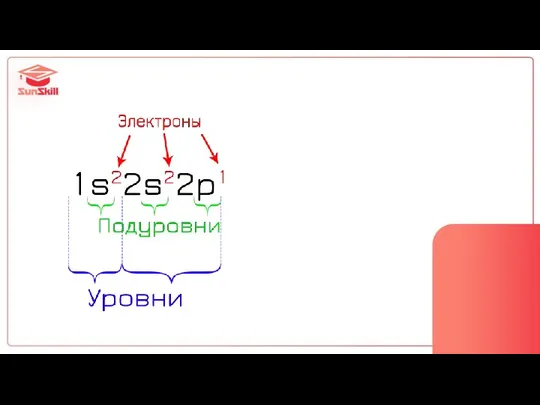
- 21. Строение электронной оболочки = конфигурация атома
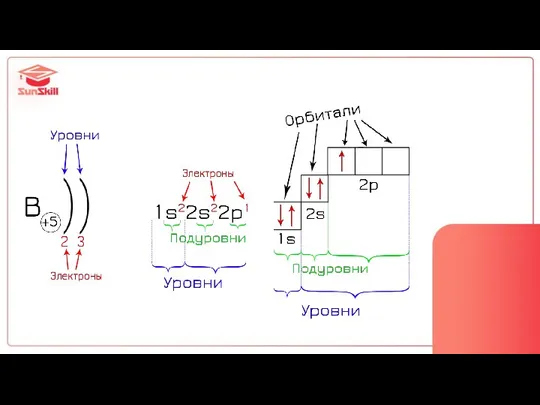
- 22. 3 вида записи строения
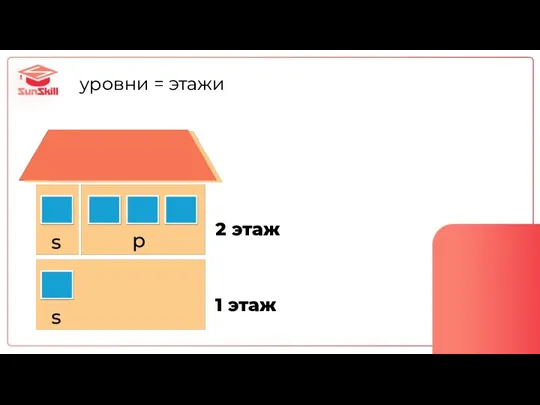
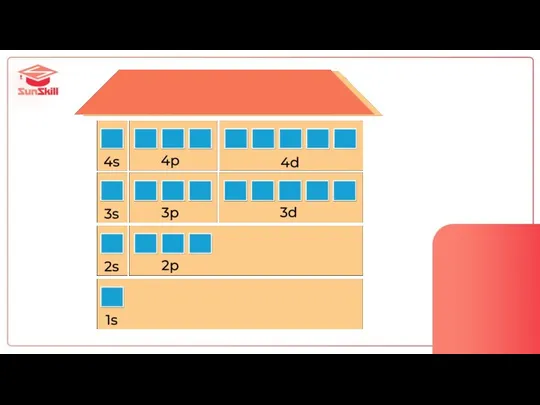
- 27. уровни = этажи 1 этаж 2 этаж
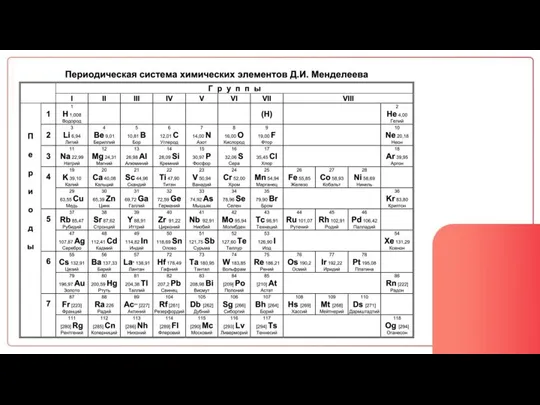
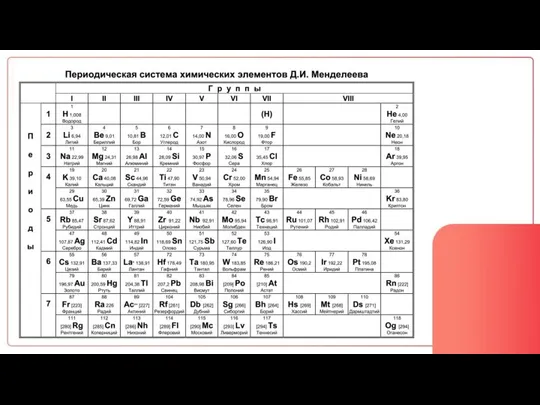
- 28. Количество уровней = Номер периода Количество e на внешнем слое = Номер группы
- 29. Распределение электронов по уровням: 2 8 18 32
- 30. Mg Cl
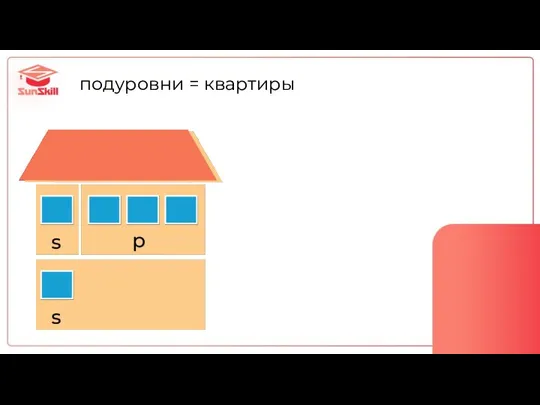
- 34. s-подуровень p-подуровень d-подуровень вмещает 2 электрона вмещает 6 электронов вмещает 10 электронов
- 38. подуровни = квартиры
- 39. Ca P
- 41. Особенность d-элементов
- 42. Изобразим конфигурацию Mn
- 43. Изобразим конфигурацию Mn 1s22s22p63s23p64s24d5
- 44. Изобразим конфигурацию Mn 1s22s22p63s23p64s23d5 1s22s22p63s23p64s24d5
- 47. d-подуровень не считается последним!
- 48. На ЕГЭ чаще всего будут просить электронную конфигурацию внешнего слоя Mg 1s22s22p63s2 Mn 1s22s22p63s23p64s23d5
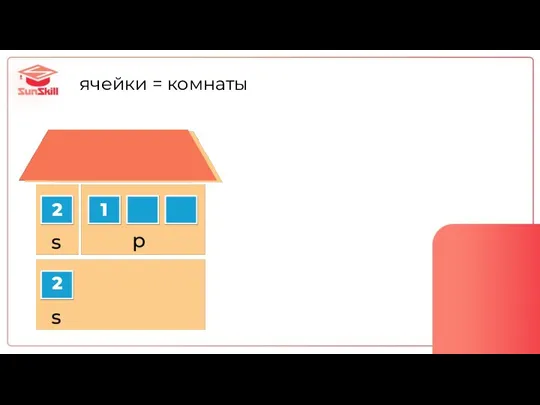
- 51. ячейки = комнаты 2 2 1
- 52. Правило 1 В одной ячейке – максимум 2 электрона
- 53. Правило 2 Спаренные электроны – всегда противоположны
- 54. Спаренные электроны Неспаренные электроны
- 55. Правило 3 На s-подуровне: 1 ячейка На p-подуровне: 3 ячейка На d-подуровне: 5 ячеек
- 57. Mn Al
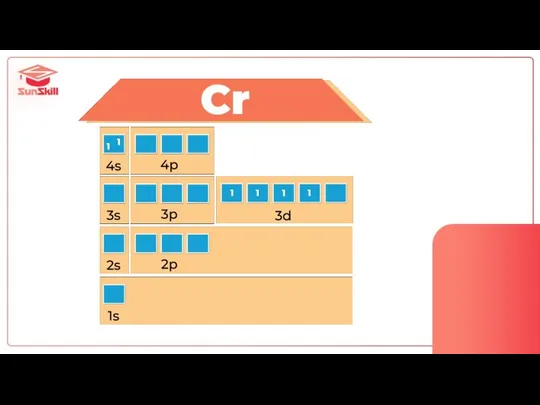
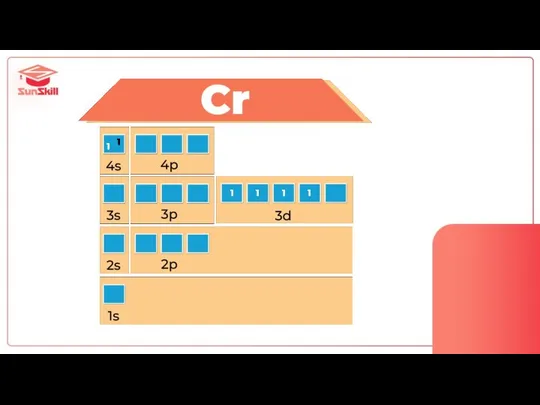
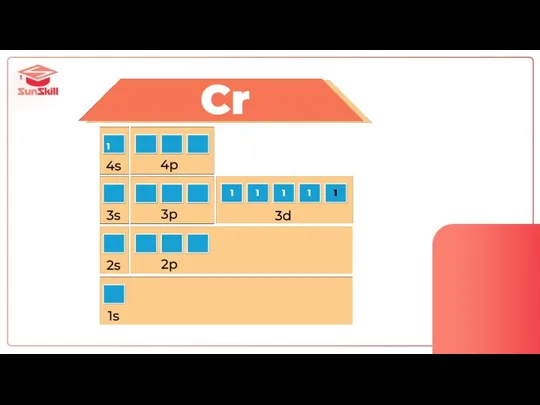
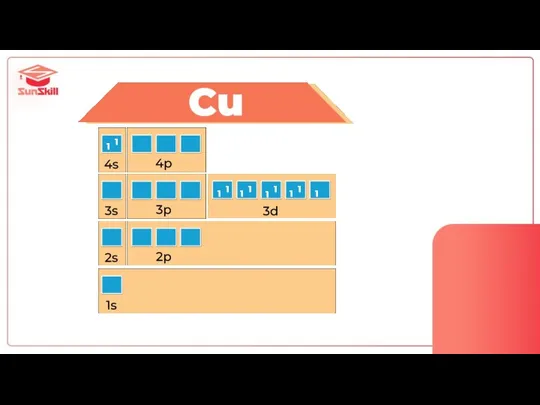
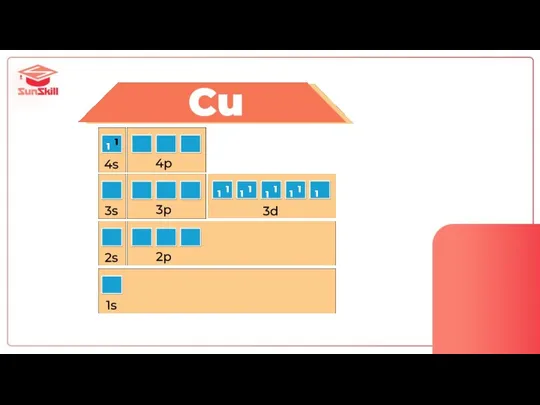
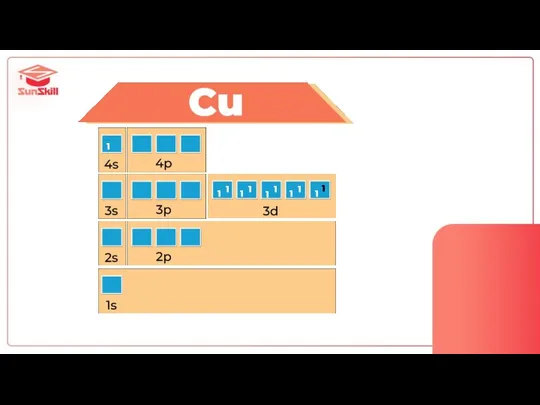
- 59. Проскок электрона Cr и Cu
- 60. Cr 4s23d4
- 62. Cr 4s23d4
- 63. Cr 4s13d5
- 64. 1 1 1 1 1 1
- 65. 1 1 1 1 1 1
- 66. 1 1 1 1 1 1
- 67. Сколько электронов у Cr на внешнем уровне?
- 68. Cu 4s23d9
- 69. Cu 4s23d9
- 70. Cu 4s13d10
- 71. 1 1 1 1 1 1 1 1 1 1 1
- 72. 1 1 1 1 1 1 1 1 1 1 1
- 73. 1 1 1 1 1 1 1 1 1 1 1
- 74. Пару терминов
- 75. Основное состояние то, что в таблице Менделеева Возбужденным атом становится, когда ему передают энергию (температура, электричество)
- 76. Внешние электроны электроны внешнего слоя
- 77. Валентные электроны электроны, которые участвуют в образовании химических связей у S-элементов и P-элементов валентные = внешние
- 78. Практика
- 79. 1) Li 2) C 3) Cl 4) Mg 5) P Определите, какие из указанных элементов на
- 80. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое количество электронов на
- 81. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную формулу внешнего энергетического
- 82. Определите, какие из указанных элементов в основном состоянии имеют на внешнем уровне один s-электрон 1) O
- 83. Определите, атомы каких из указанных элементов имеют три валентных электрона 1) N 2) B 3) Si
- 84. Определите атомы, каких из указанных в ряду элементов в основном состоянии имеют 3 неспаренных электрона 1)
- 85. Определите, атомы каких из указанных в ряду элементов в основном состоянии не содержат неспаренных электронов. 1)
- 86. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое количество внешних электронов
- 87. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат валентные электроны на 2s-
- 89. Скачать презентацию






















































 Физическая и коллоидная химия
Физическая и коллоидная химия Хімічний експеримент
Хімічний експеримент Презентация на тему Соединения химических элементов
Презентация на тему Соединения химических элементов  Свинец (plumbum)
Свинец (plumbum) Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Общая характеристика галогенов
Общая характеристика галогенов Общие свойства металлов
Общие свойства металлов Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Периодический закон, 9 класс (1)
Периодический закон, 9 класс (1) Аллотропия Аллотропные видоизменения (модификации)
Аллотропия Аллотропные видоизменения (модификации) Железо и его соединения
Железо и его соединения Стелс-материалы
Стелс-материалы ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Общие химические свойства металлов
Общие химические свойства металлов Спазган: применение, форма, свойства, состав
Спазган: применение, форма, свойства, состав Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Оксидті шикізаттан темір ұнтағын алу технологиясын жасау
Оксидті шикізаттан темір ұнтағын алу технологиясын жасау Капрон
Капрон АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ
АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ Планетарная модель атома и его строение
Планетарная модель атома и его строение Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом
Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом Реализация системно-деятельностного подхода совместно с компьютерными технологиями в преподавании химии
Реализация системно-деятельностного подхода совместно с компьютерными технологиями в преподавании химии Составление формул солей
Составление формул солей Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Химическая связь. Строение вещества
Химическая связь. Строение вещества Презентация по Химии "Белки как основа всего живого"
Презентация по Химии "Белки как основа всего живого"