Слайд 2Химическая связь - взаимодействие атомов, связывающее их в единую устойчивую систему (молекулу,

ион, кристалл и др.)
Слайд 5Способы перекрывания электронных облаков:
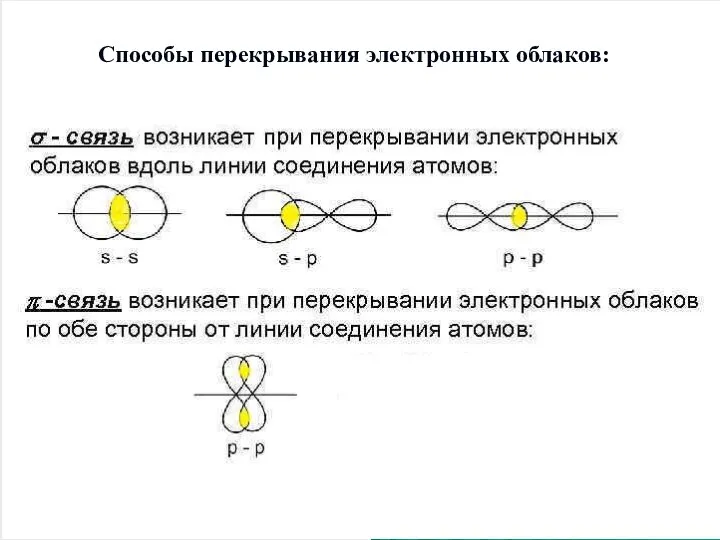
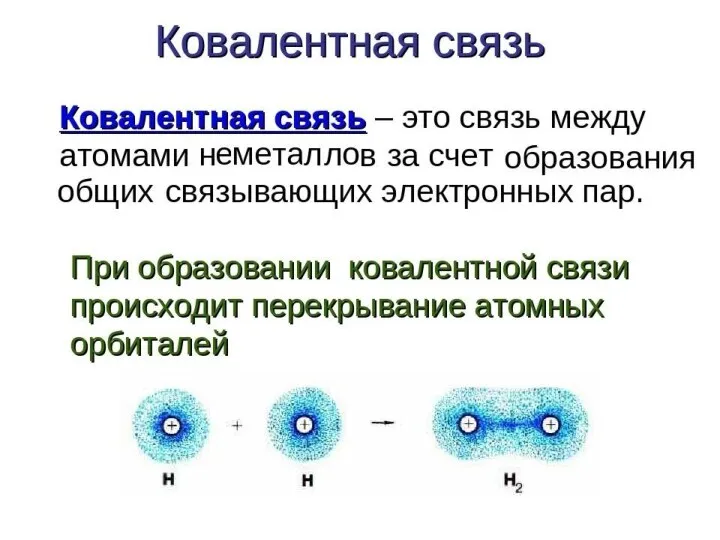
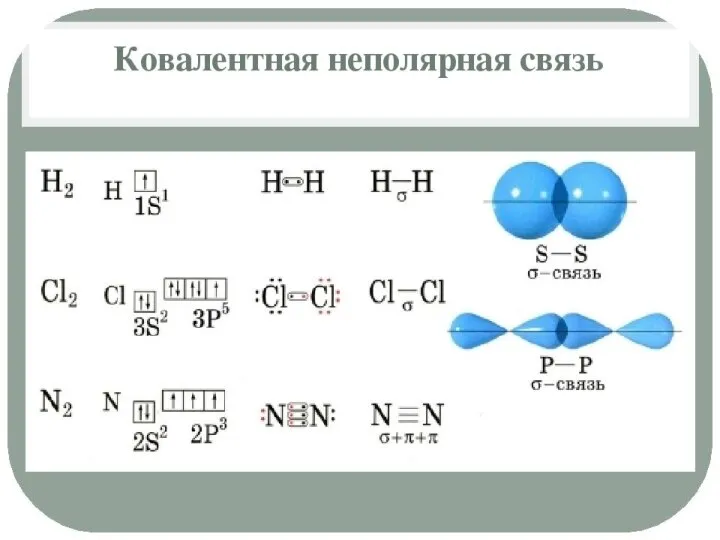
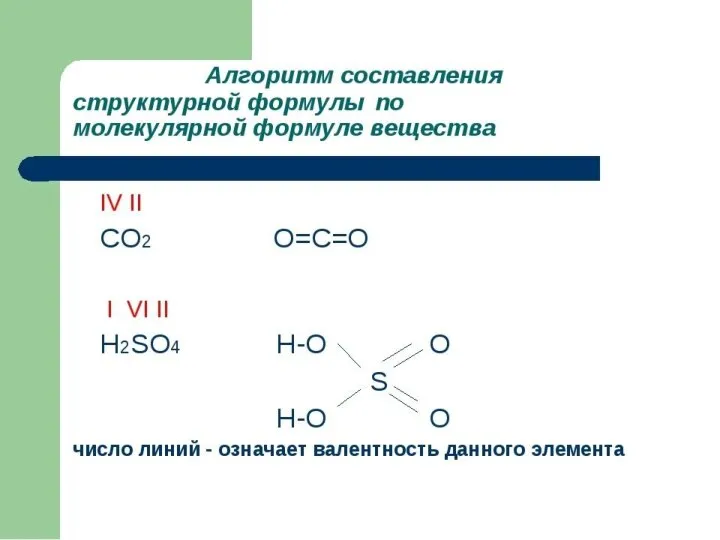
Слайд 6Характеристики ковалентной связи:
Энергия связи – энергия, которую необходимо затратить для разрыва данной

связи. Измеряется в кДж/моль. Зависит от радиуса перекрывающихся облаков.
Кратность связи – число химических связей между двумя атомами. Её можно показать сплошной линией между атомами либо точками. Чем больше кратность связи, тем прочнее связь.
Длина связи – расстояние между ядрами атомов в молекуле. Измеряется в нм.
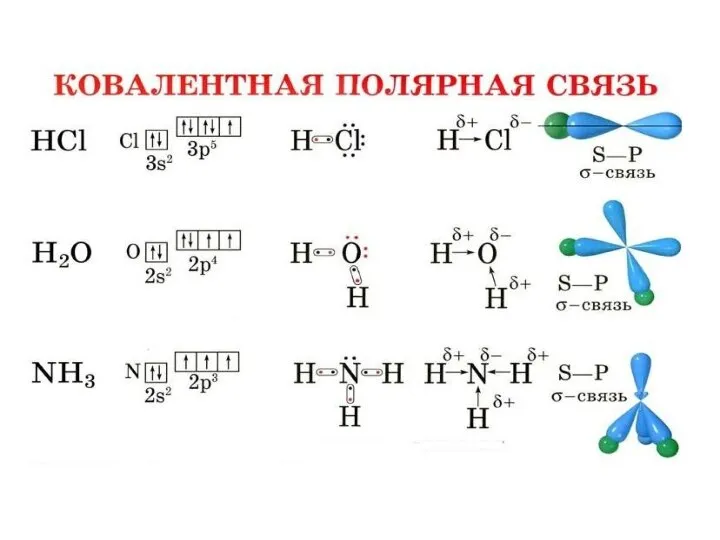
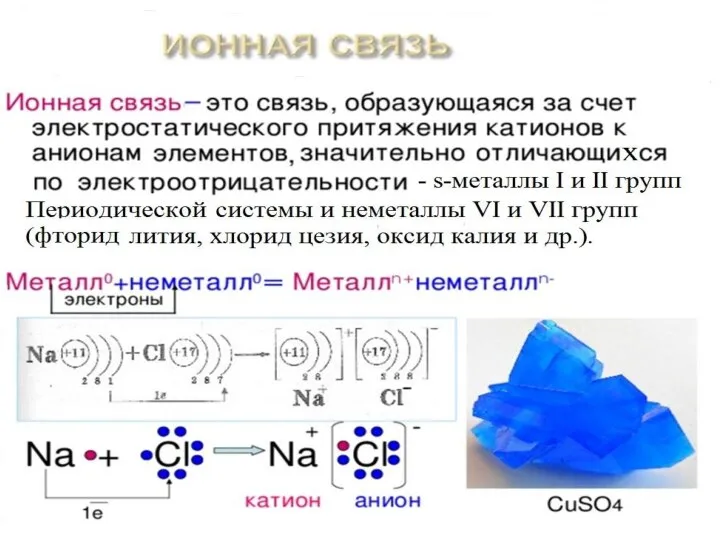
Полярность связи – смещение общей электронной плотности к более электроотрицательному атому. В зависимости от этого ковалентная связь делится на полярную и неполярную
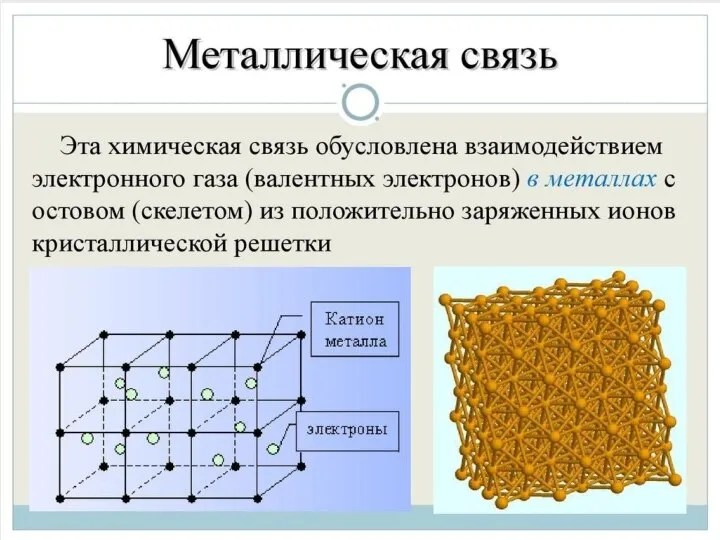
Слайд 11Металлическая связь - химическая связь в металлах и их сплавах. Данным видом
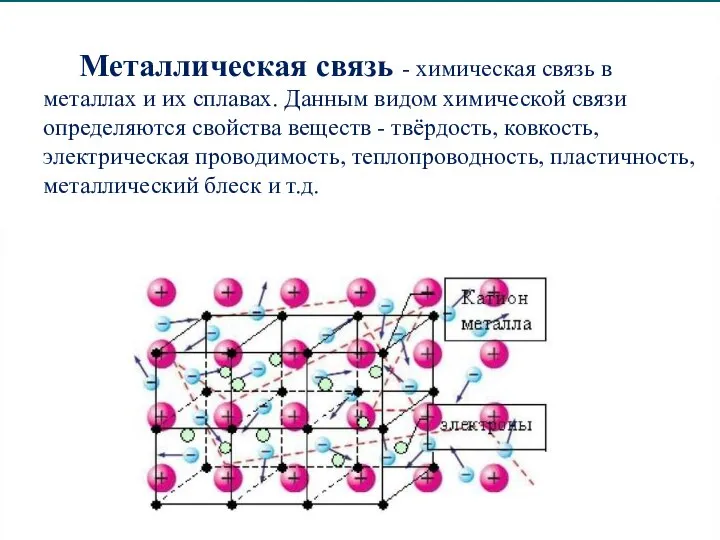
химической связи определяются свойства веществ - твёрдость, ковкость, электрическая проводимость, теплопроводность, пластичность, металлический блеск и т.д.
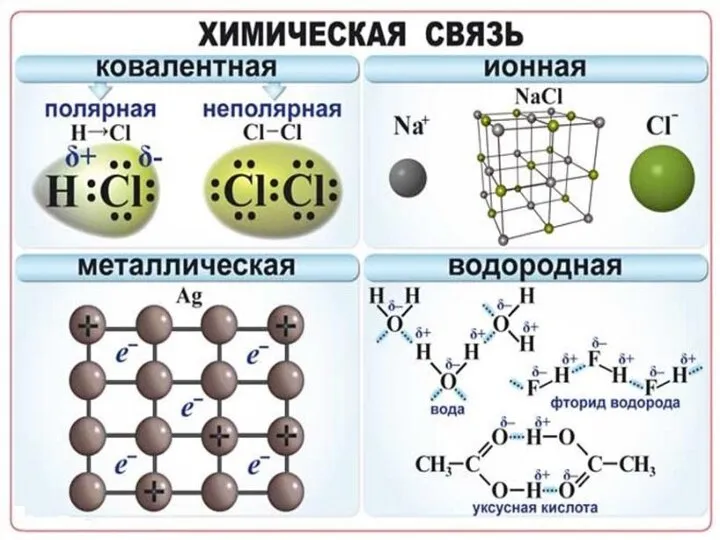
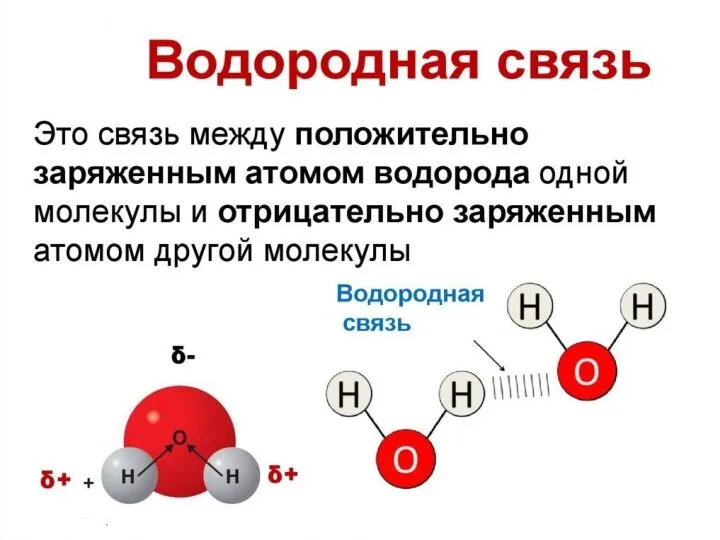
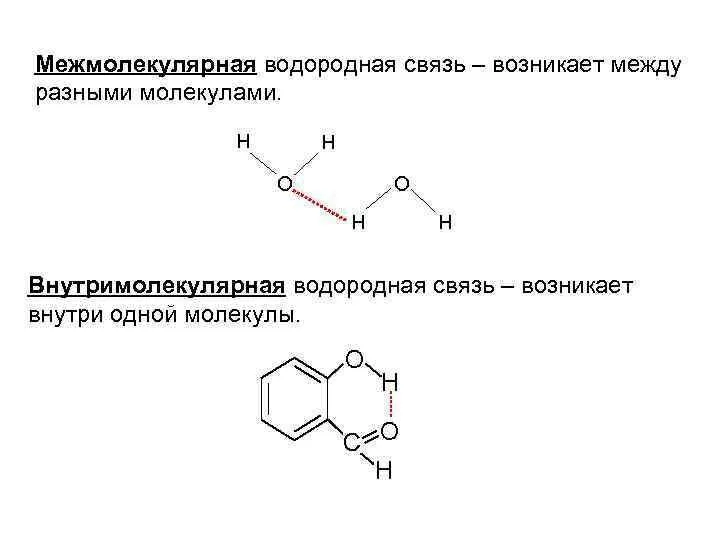
Слайд 15Наличие водородной связи обуславливает физические и химические свойства вещества - высокие температуры

плавления и кипения, хорошую растворимость, высокую испаряемость. Связь слабая и легко рвётся, но множество таких связей способно породить силу, на которой, в буквальном смысле, держится всё живое. Соединения с водородной связью - спирты, карбоновые кислоты, амины, аминокислоты, белки, вода, аммиак, фтороводород








 Альдегиды. Получение и применение
Альдегиды. Получение и применение Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Презентация на тему Алкины
Презентация на тему Алкины  Химия. 8 класс
Химия. 8 класс 11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс
11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс ОВР химияПрезентация
ОВР химияПрезентация Галогены и их соединения
Галогены и их соединения Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Железо
Железо Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Вяжущие вещества
Вяжущие вещества Bool-doser team
Bool-doser team Воздух и его свойства
Воздух и его свойства Строение атома
Строение атома ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Химия в еде
Химия в еде Презентация на тему Полимеры
Презентация на тему Полимеры  Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Сложные вещества. Основания
Сложные вещества. Основания Реакции этерификации
Реакции этерификации 11 класс 15.09
11 класс 15.09 Обмен липидов
Обмен липидов Кислоты в природе и дома. 8 класс
Кислоты в природе и дома. 8 класс 01. Химический состав
01. Химический состав