Содержание
- 2. Химия как наука. Основные понятия и законы химии
- 3. Михаил Васильевич Ломоносов (1711–1765) Широко распростирает химия руки свои в дела человеческие… Куда ни посмотрим, куда
- 4. Химические вещества вокруг нас Розовый кварц SiO2 Гипс CaSO4·2H2O Пирит FeS2 Минералы и горные породы
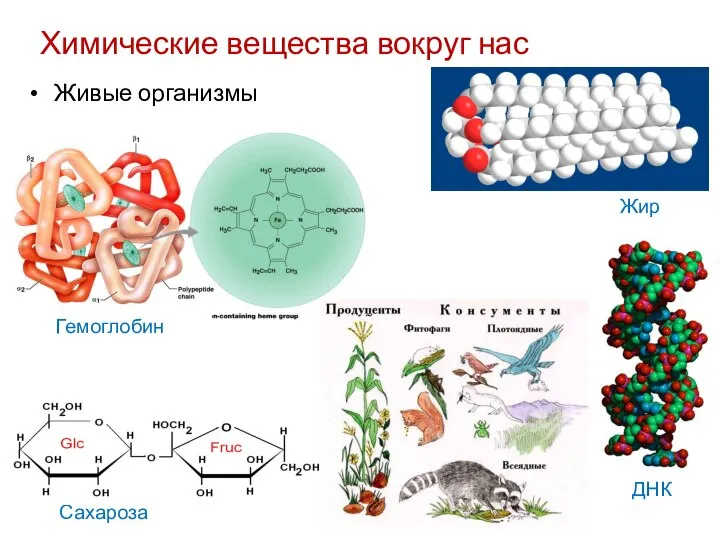
- 5. Химические вещества вокруг нас Сахароза Живые организмы Гемоглобин Жир ДНК
- 6. Химические вещества вокруг нас Полипропилен Предметы быта Полиэтилен [–CH2–CH2–]n Поливинилхлорид Тефлон [–CF2–CF2–]n Полистирол Нитрон
- 7. Экологические проблемы
- 8. Предмет химии
- 9. Уровни явлений (условно) Астрономический – от млн. световых лет до млн. км Макроскопический – от сотен
- 10. Химия наука, изучающая процессы превращения веществ, сопровождающиеся изменением их состава и структуры Главный объект – вещества
- 11. Виды материи Вещество – вид материи, дискретные (элементарные) частицы которого имеют собственную массу (массу покоя) Элементарные
- 12. Химия наука, изучающая процессы превращения веществ, сопровождающиеся изменением их состава и структуры Взаимосвязь химической и других
- 13. Химические реакции превращения веществ, сопровождающиеся изменением их состава По признаку выделения и поглощения теплоты – экзо-
- 14. Разделы химии (примеры) Агрохимия Аналитическая химия Биогеохимия Биохимия Геохимия Квантовая химия Коллоидная химия Космохимия Кристаллохимия Математическая
- 15. Основные понятия химии
- 16. Атомно-молекулярное учение Древнегреческие ученые М. В. Ломоносов, 1741 Все вещества состоят из молекул («корпускул») Молекулы состоят
- 17. Определения понятий атом и молекула Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно
- 18. Массы атомов и молекул Атомная единица массы 1 а. е. м. = 1,66·10–27 кг Абсолютная масса
- 19. Моль количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов, ядер, электронов, радикалов), сколько содержится
- 20. Химический элемент вид атомов, ионов, ядер с определенным зарядом ядра Элемент водород: атомы 1H (протий), 2H
- 21. Химическое вещество Простое вещество – химический элемент в свободном виде Аллотропия – явление существования одного химического
- 22. Фуллерены Ричард Смолли, Харольд Крото, Роберт Флойд Кёрл, Джеймс Хит и Шон О'Брайен (1985 г.) Нобелевская
- 23. Химическое вещество Простое вещество – химический элемент в свободном виде Аллотропия – явление существования одного химического
- 24. Стехиометрические законы химии Стехиометрия – раздел химии, рассматривающий количественные (массовые, объемные) соотношения между реагирующими веществами
- 25. Закон сохранения массы веществ М. В. Ломоносов, 1748 Экспериментальное подтверждение – 1756 Масса веществ, вступающих в
- 26. Закон постоянства состава вещества Спор Ж. Л. Пруста и К. Л. Бертолле Ж. Л. Пруст, 1799–1806
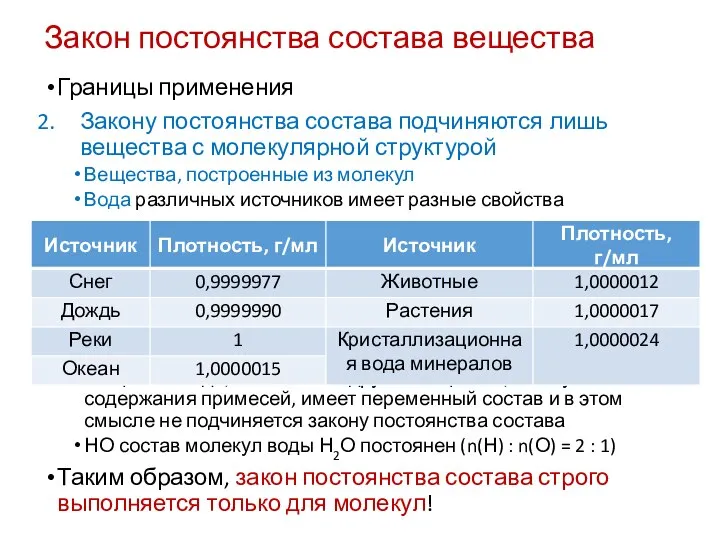
- 27. Закон постоянства состава вещества Границы применения Постоянен лишь атомный состав вещества (массовый состав непостоянен) Изотопы (греч.
- 28. Закон постоянства состава вещества Границы применения Закону постоянства состава подчиняются лишь вещества с молекулярной структурой Твердые
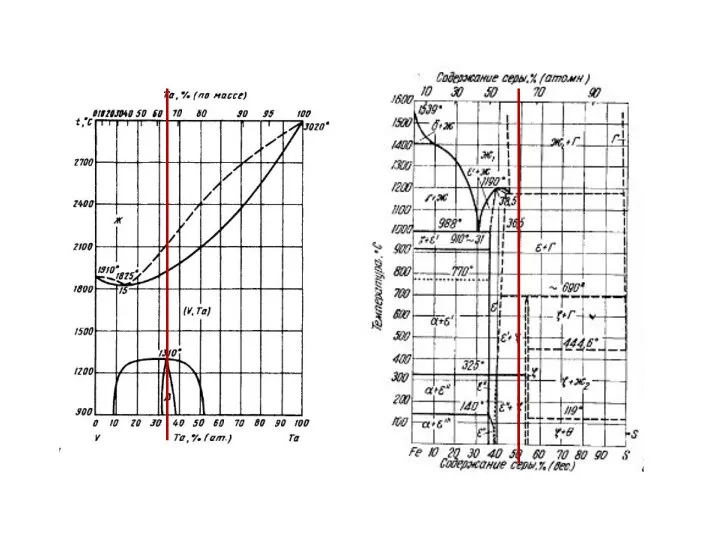
- 29. Область гомогенности область составов, в которой существует данное химическое соединение Va2Ta – 31–37 ат.% Ta NaCl
- 31. Закон постоянства состава вещества Границы применения Закону постоянства состава подчиняются лишь вещества с молекулярной структурой Вещества,
- 32. Закон объемных отношений Ж. Л. Гей-Люссак, 1805–1808 Объемы вступающих в реакцию газов при одинаковых условиях (температуре
- 33. Закон Авогадро А. Авогадро, 1811 В равных объемах различных газов при одинаковых условиях (Т и р)
- 34. Относительная плотность газа число, показывающее, во сколько раз один газ тяжелее другого Относительная плотность газа Х
- 35. Эквивалент Эквивалент Э – число единиц массы элемента, химически равноценное 8 единицам массы кислорода или 1,008
- 36. Эквивалент Эквивалент – реальная или условная частица вещества, которая может при химических реакциях присоединять или замещать
- 37. Эквивалент простого вещества частица вещества (реальная или условная), которая приходится на единицу валентности (степени окисления) соответствующего
- 38. Эквивалент кислоты частица кислоты (реальная или условная), в z раз меньшая ФЕ, где z – основность
- 39. Эквивалент основания частица основания (реальная или условная), в z раз меньшая ФЕ, где z – кислотность
- 40. Эквивалент соли частица соли (реальная или условная), в z раз меньшая ФЕ, где z – число
- 41. Окислительно-восстановительный (электрохимический) эквивалент реальная или условная частица окислителя (или восстановителя), которая в окислительно-восстановительной реакции принимает (или
- 42. Молярная масса эквивалентов М(1/zХ) масса 1 моль эквивалентов вещества (1/z)Х (единица измерения г/моль) 1 моль эквивалентов
- 44. Скачать презентацию



![Химические вещества вокруг нас Полипропилен Предметы быта Полиэтилен [–CH2–CH2–]n Поливинилхлорид Тефлон [–CF2–CF2–]n Полистирол Нитрон](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1119269/slide-5.jpg)


































 Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка
Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка Виды автомобильного топлива
Виды автомобильного топлива Бор и его соединения
Бор и его соединения Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ Ртуть. Правила работы со ртутью
Ртуть. Правила работы со ртутью Фенолы
Фенолы Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Физические свойства водорода
Физические свойства водорода Спирты или алканолы
Спирты или алканолы Агрегатное состояние вещества
Агрегатное состояние вещества Полезные ископаемые
Полезные ископаемые Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Основы химической термодинамики
Основы химической термодинамики Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Формула аспирина. Решение задач
Формула аспирина. Решение задач Презентация на тему Менделеев Дмитрий Иванович
Презентация на тему Менделеев Дмитрий Иванович  Витамины. (10 класс)
Витамины. (10 класс) Гордость земли Большемурашкинской: Владимир Васильевич Марковников
Гордость земли Большемурашкинской: Владимир Васильевич Марковников Пластмассы. Классификация
Пластмассы. Классификация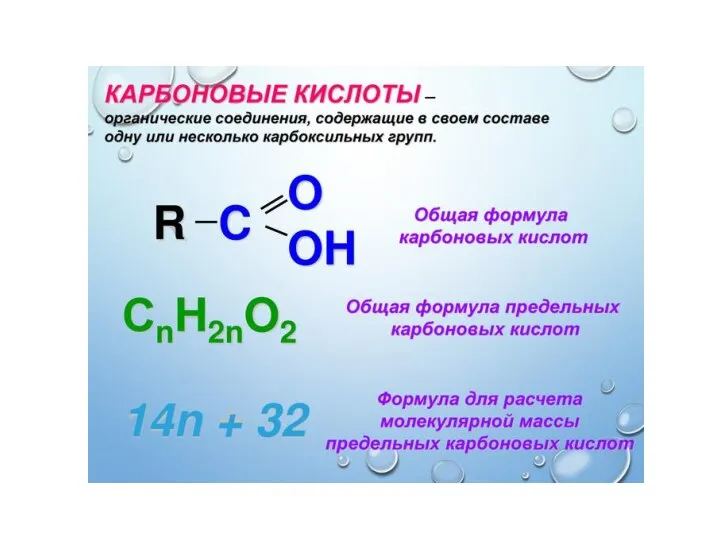 Карбоновые кислоты
Карбоновые кислоты Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Непредельные углеводороды
Непредельные углеводороды Типы химических реакций
Типы химических реакций Химический элемент Ferrum(2,3)
Химический элемент Ferrum(2,3) Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів