Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства
Содержание
- 2. План 1. Понятие о гетероциклических соединениях и их классификация. 2. Производные этиленимина как противоопухолевые средства: тиофосфамид,
- 3. Понятие о гетероциклических соединениях Гетероциклические соединения – это соединения, в молекулах которых содержатся циклы, в состав
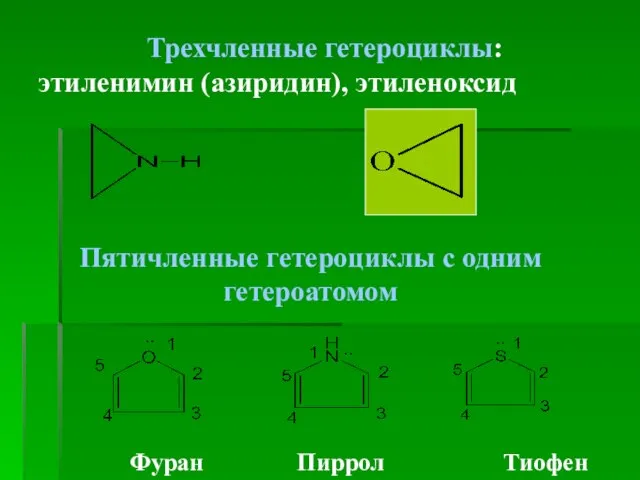
- 4. Трехчленные гетероциклы: этиленимин (азиридин), этиленоксид Фуран Пиррол Тиофен Пятичленные гетероциклы с одним гетероатомом
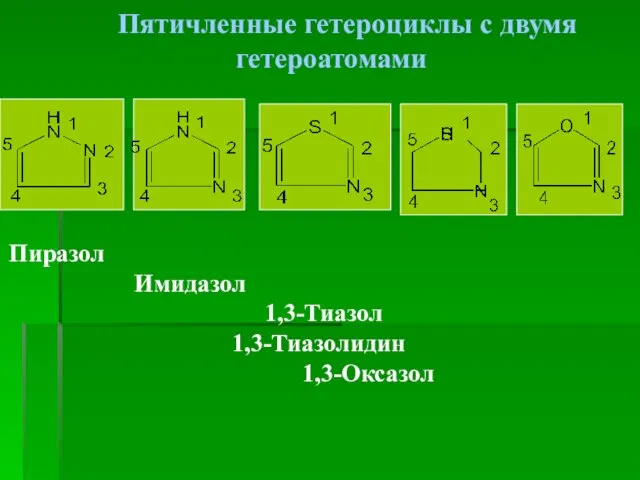
- 5. Пятичленные гетероциклы с двумя гетероатомами Пиразол Имидазол 1,3-Тиазол 1,3-Тиазолидин 1,3-Оксазол
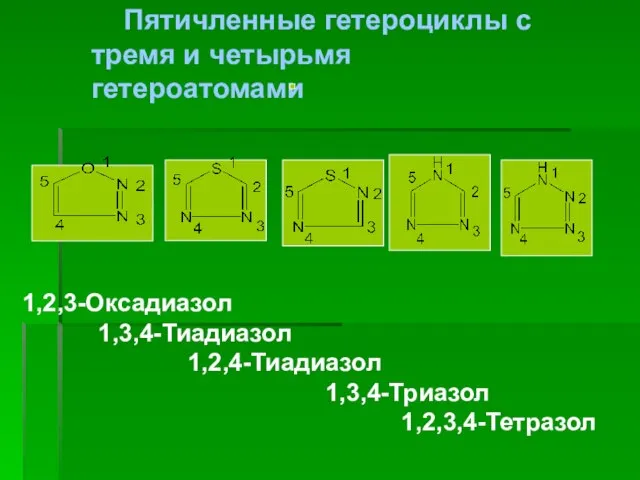
- 6. Пятичленные гетероциклы с тремя и четырьмя гетероатомами 1,2,3-Оксадиазол 1,3,4-Тиадиазол 1,2,4-Тиадиазол 1,3,4-Триазол 1,2,3,4-Тетразол
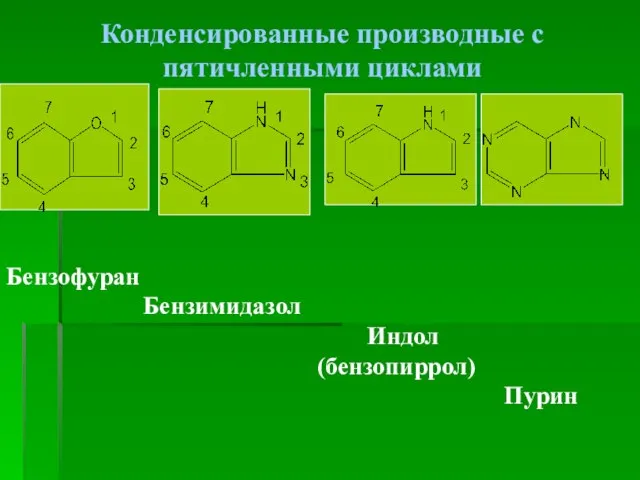
- 7. Конденсированные производные с пятичленными циклами Бензофуран Бензимидазол Индол (бензопиррол) Пурин
- 8. Производные этиленимина как противоопухолевые средства (Беликов) Этиленимин (азиридин) – Производные этиленимина являются цитостатическими средствами. Они способны
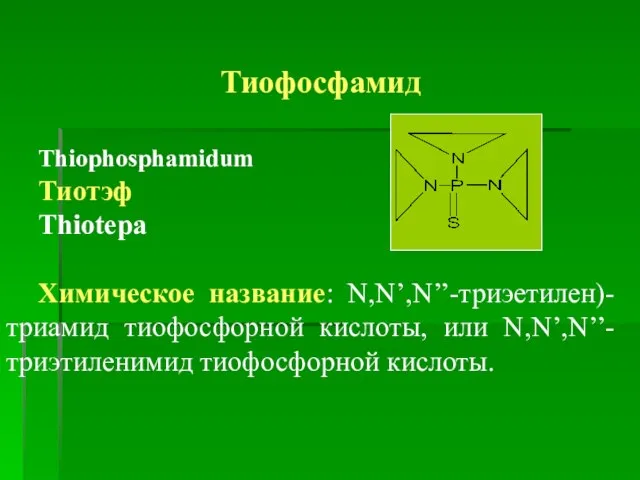
- 9. Тиофосфамид Thiophosphamidum Тиотэф Thiotepa Химическое название: N,N’,N’’-триэетилен)-триамид тиофосфорной кислоты, или N,N’,N’’-триэтиленимид тиофосфорной кислоты.
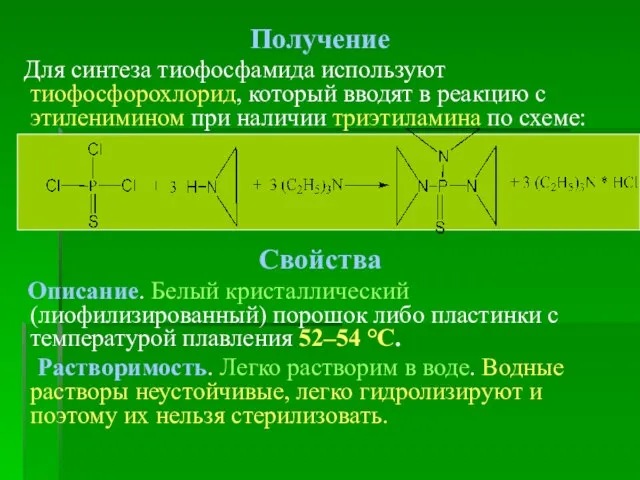
- 10. Получение Для синтеза тиофосфамида используют тиофосфорохлорид, который вводят в реакцию с этиленимином при наличии триэтиламина по
- 11. Идентификация 1. Выявление Фосфора после минерализации препарата Тиофосфамид кипятят с конц. HNO3 или смесью конц. H2SO4
- 12. 3. Идентификация имидных групп а) Молекулу тиофосфамида разрушают, нагревая с р-ром калий дихромата K2Cr2O7 в пробирке,
- 13. Количественное определение Ацидиметрия, по заместителю (обратный тиосульфатный метод) При взаимодействии субстанции с р-ром натрий тиосульфата Na2S2O3
- 14. Хранение. Список ядовитых и наркотических веществ. В плотно укупор. контейнерах, при температуре не выше +10 °С.
- 15. Обычно вводят 3 раза в неделю под систематическим гематологическим контролем. Может угнетать кроветворную функцию костного мозга,
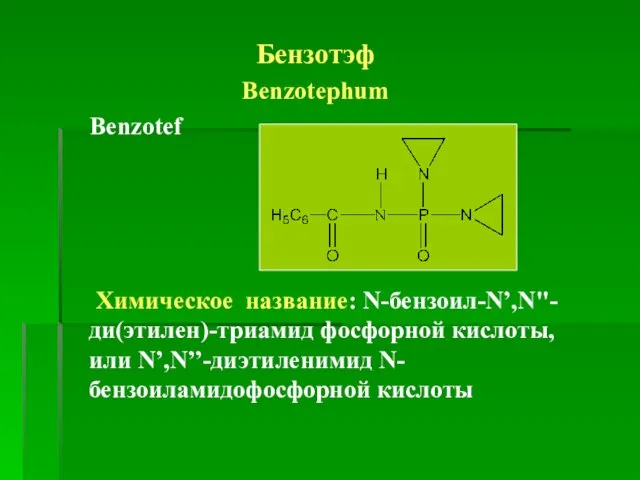
- 16. Бензотэф Benzotephum Benzotef Химическое название: N-бензоил-N’,N''-ди(этилен)-триамид фосфорной кислоты, или N’,N’’-диэтиленимид N-бензоиламидофосфорной кислоты
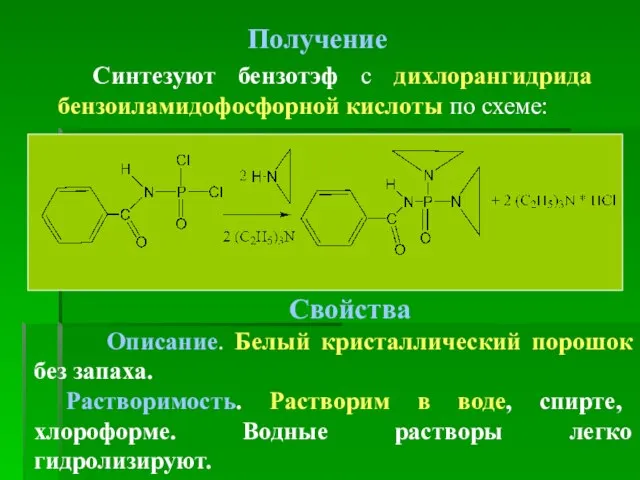
- 17. Получение Синтезуют бензотэф с дихлорангидрида бензоиламидофосфорной кислоты по схеме: Свойства Описание. Белый кристаллический порошок без запаха.
- 18. Идентификация (проводят аналогично тиофосфамиду) 1. Выявление Фосфора после минерализации препарата конц. HNO3 или смесью конц. H2SO4
- 19. 3. Идентификация имидных групп а) Молекулу бензотэфа разрушают, нагревая с р-ром калий дихромата K2Cr2O7 в пробирке,
- 20. Количественное определение Ацидиметрия, по заместителю(см. тиофосфамид). Еm = М. м/2 Хранение. Список ядовитых и наркотических веществ.
- 21. Выпускают в запаянных ампулах или герметически закрытых флаконах по 25 мг препарата у виде порошка. Растворы
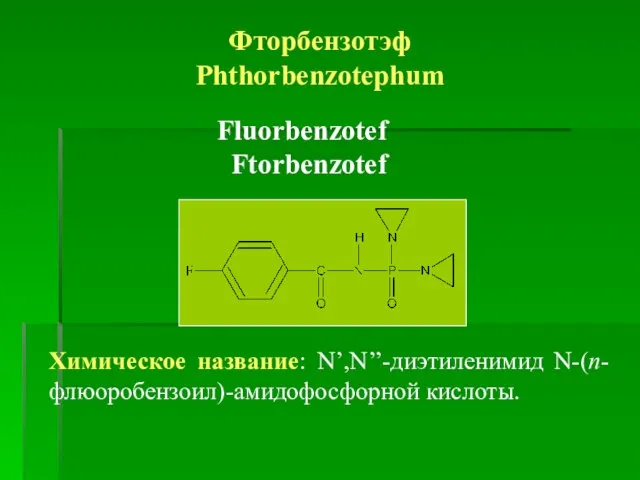
- 22. Фторбензотэф Phthorbenzotephum Fluorbenzotef Ftorbenzotef Химическое название: N’,N’’-диэтиленимид N-(п-флюоробензоил)-амидофосфорной кислоты.
- 23. Получение Синтезирован фторбензотэф в Киевском институте фармакологии и токсикологии под руководством проф. Л. Проценко. Свойства Описание.
- 24. Идентификация 1. Выявление Фосфора после минерализации препарата (см. тиофосфамид и бензотэф) 2. Идентификация имидных групп (см.
- 25. Применение. Противоопухолевое средство По строению и механизму действия близок к бензотэфу. Применяют при гипернефроидном раке почек
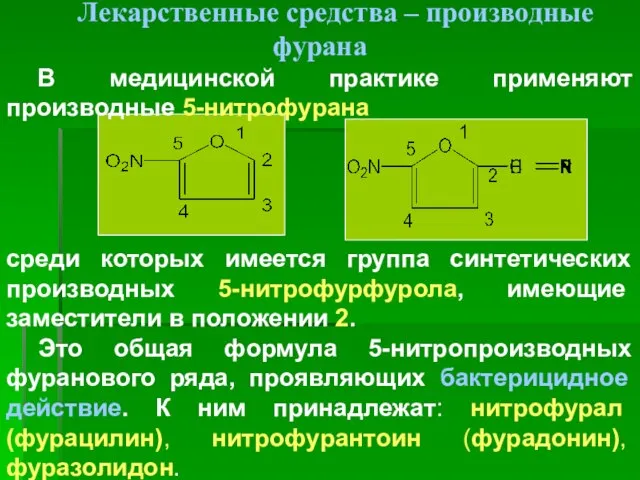
- 26. Лекарственные средства – производные фурана В медицинской практике применяют производные 5-нитрофурана среди которых имеется группа синтетических
- 27. Нитрофураны похожи по химическому строению, физическими и химическими свойствами и фармакологическому действию. Они активны относительно граммположительных
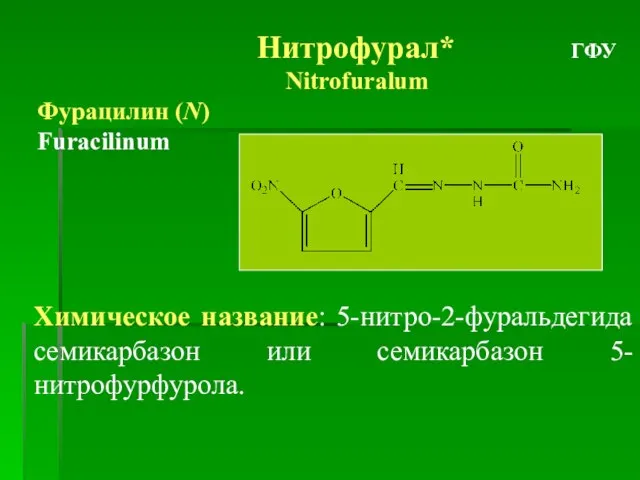
- 28. Нитрофурал* ГФУ Nitrofuralum Фурацилин (N) Furacilinum Химическое название: 5-нитро-2-фуральдегида семикарбазон или семикарбазон 5-нитрофурфурола.
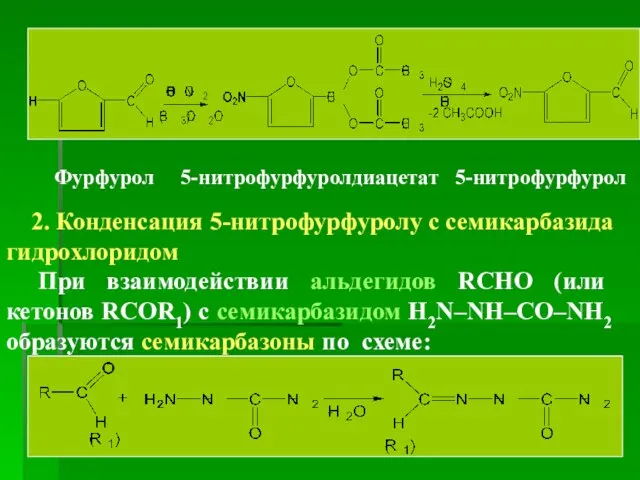
- 29. Получение Синтез из фурфурола 1. Нитрование фурфурола (фуран-2-карбальдегид) Производные фурана – ацидофобные вещества (неустойчивы в кислой
- 30. Фурфурол 5-нитрофурфуролдиацетат 5-нитрофурфурол 2. Конденсация 5-нитрофурфуролу с семикарбазида гидрохлоридом При взаимодействии альдегидов RCHO (или кетонов RCOR1)
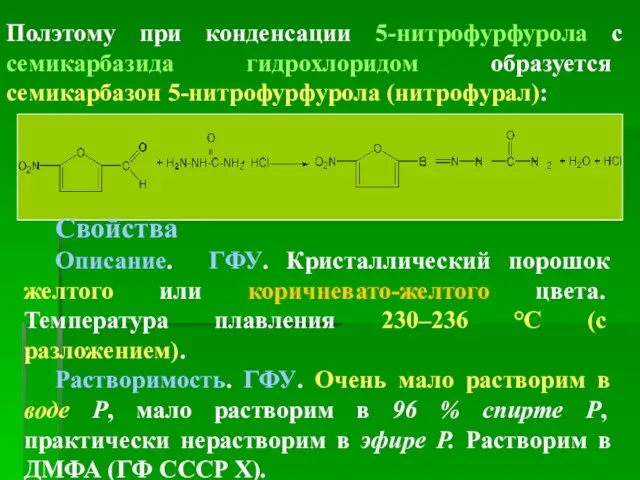
- 31. Полэтому при конденсации 5-нитрофурфурола с семикарбазида гидрохлоридом образуется семикарбазон 5-нитрофурфурола (нитрофурал): Свойства Описание. ГФУ. Кристаллический порошок
- 32. Идентификация Первая идентификация: В. Вторая идентификация: А, С, D. А. УФ-спектроскопия. Испытание проводят в защищенном от
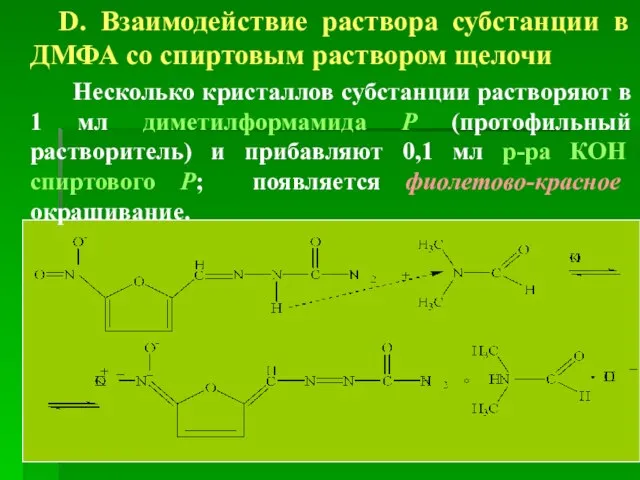
- 33. D. Взаимодействие раствора субстанции в ДМФА со спиртовым раствором щелочи Несколько кристаллов субстанции растворяют в 1
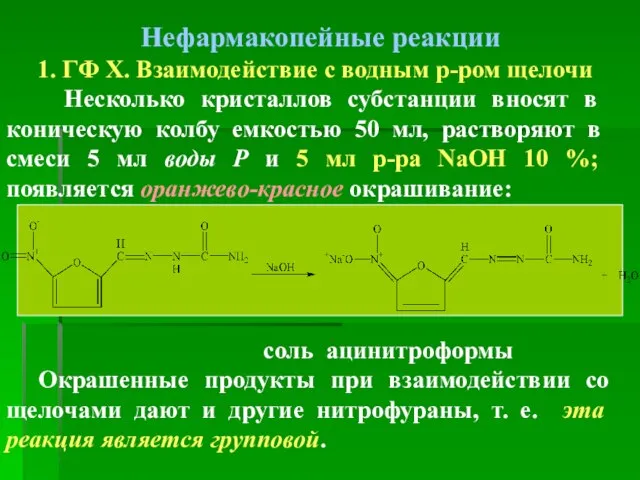
- 34. Нефармакопейные реакции 1. ГФ Х. Взаимодействие с водным р-ром щелочи Несколько кристаллов субстанции вносят в коническую
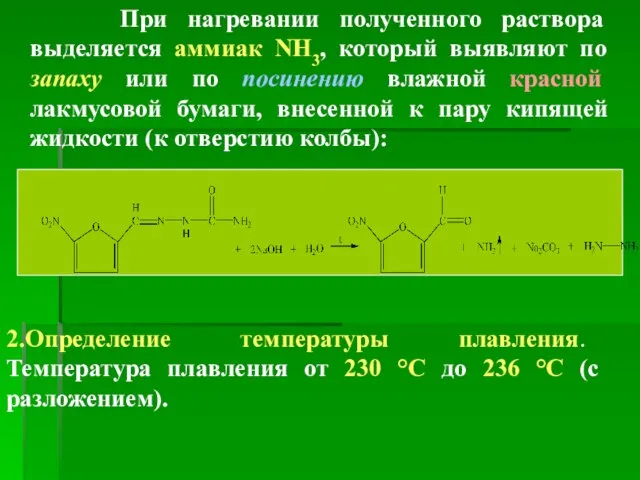
- 35. При нагревании полученного раствора выделяется аммиак NH3, который выявляют по запаху или по посинению влажной красной
- 36. Испытания на чистоту 1. Измерение рН. От 5,0 до 7,0. 2. Сопутствующие примеси полупродуктов синтеза определяют
- 37. Количественное определение Испытания проводят в защищ. от яркого света месте. ГФУ. УФ-спектрофотометрия Измеряют оптическую плотность р-ра
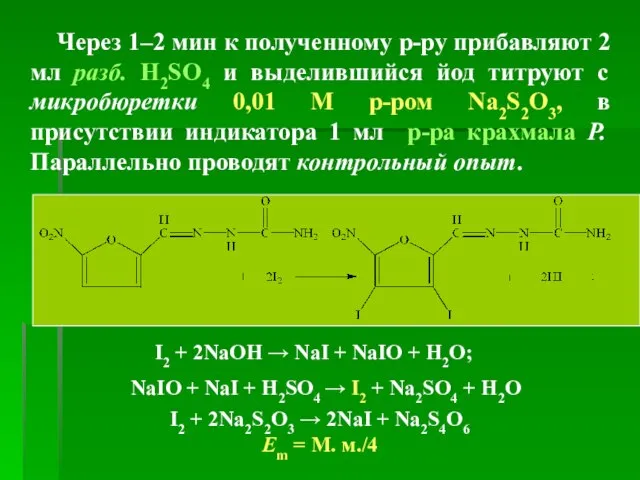
- 38. Через 1–2 мин к полученному р-ру прибавляют 2 мл разб. H2SO4 и выделившийся йод титруют с
- 39. 3. Фотоколориметрия Сущность метода состоит в измерении оптической плотности окрашенного в оранжево-красный цвет щелочного раствора нитрофурала.
- 40. Применение. Антибактериальное средство. Для фурацилина характерно влияние на грамотрицательные и грамположительные бактерии (стафилококки, стрептококки, дизентерийная палочка,
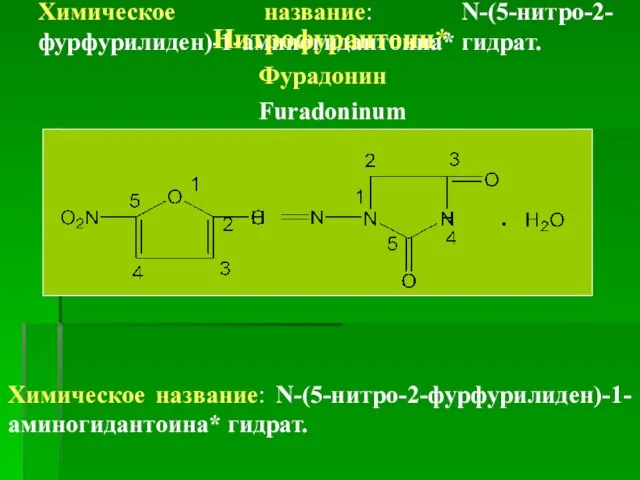
- 41. Химическое название: N-(5-нитро-2-фурфурилиден)-1-аминогидантоина* гидрат. Нитрофурантоин* Фурадонин Furadoninum Химическое название: N-(5-нитро-2-фурфурилиден)-1-аминогидантоина* гидрат.
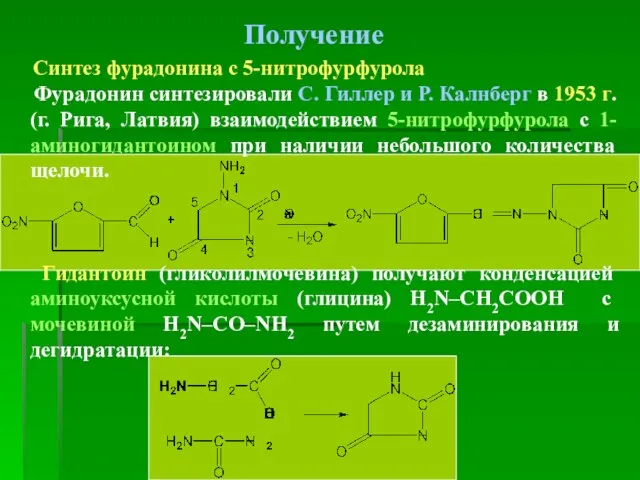
- 42. Получение Синтез фурадонина с 5-нитрофурфурола Фурадонин синтезировали С. Гиллер и Р. Калнберг в 1953 г. (г.
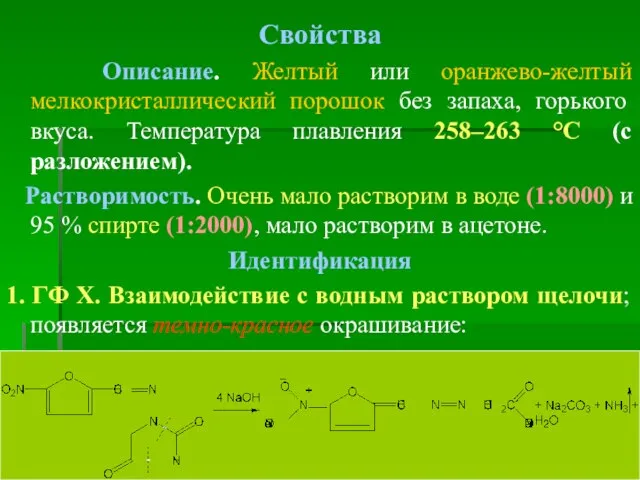
- 43. Свойства Описание. Желтый или оранжево-желтый мелкокристаллический порошок без запаха, горького вкуса. Температура плавления 258–263 °С (с
- 44. 2. ГФ Х. Взаимодействие раствора субстанции в ДМФА со спиртовым раствором щелочи Несколько кристаллов субстанции раствор.
- 45. 2. Алкалиметрия, неводное титрование Навеску субстанции раствор. в протофильном растворителе (ДМФА, пиридин, бутиламин) и титруют станд.
- 46. Хранение Список сильнодействующих веществ. В плотно укупоренном контейнере, в склянках с темного стекла, в прохладном, защищенном
- 47. Назначают внутрь взрослым по 0,1–0,15 г 3–4 раза в день, запивая большим количеством жидкости. Не следует
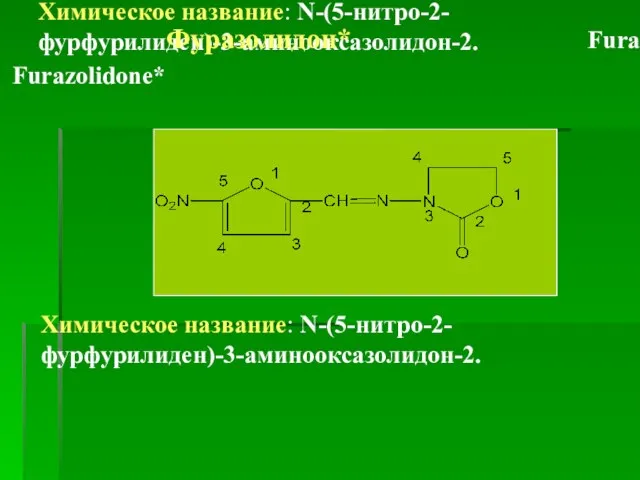
- 48. Химическое название: N-(5-нитро-2-фурфурилиден)-3-аминооксазолидон-2. Фуразолидон* Furazolidonum Furazolidone* Химическое название: N-(5-нитро-2-фурфурилиден)-3-аминооксазолидон-2.
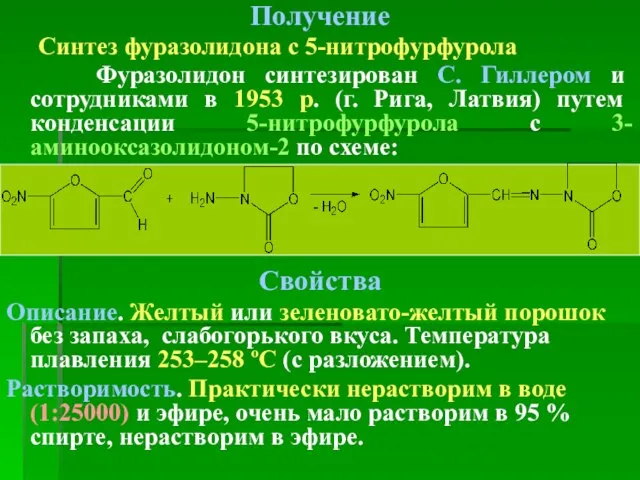
- 49. Получение Синтез фуразолидона с 5-нитрофурфурола Фуразолидон синтезирован С. Гиллером и сотрудниками в 1953 р. (г. Рига,
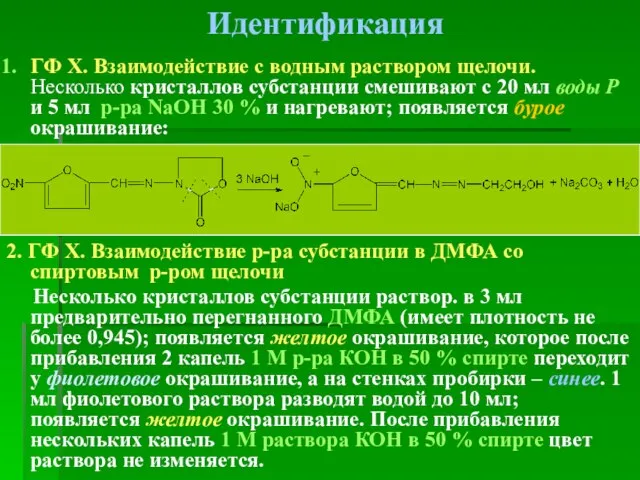
- 50. Идентификация ГФ Х. Взаимодействие с водным раствором щелочи. Несколько кристаллов субстанции смешивают с 20 мл воды
- 51. Количественное определение 1. ГФ Х. Фотоколориметрия Метод основан на измерении поглощения света у видимой области спектра
- 52. Испытания на чистоту 1. Посторонние вещества. 0,2 г препарата смешивают с 1 мл воды и 0,5
- 53. Применение. Антибактериальное и антипротозойное средство Действует на грамположительные и грамотрицательные бактерии, обладает противотрихомонадной активностью и эффективен
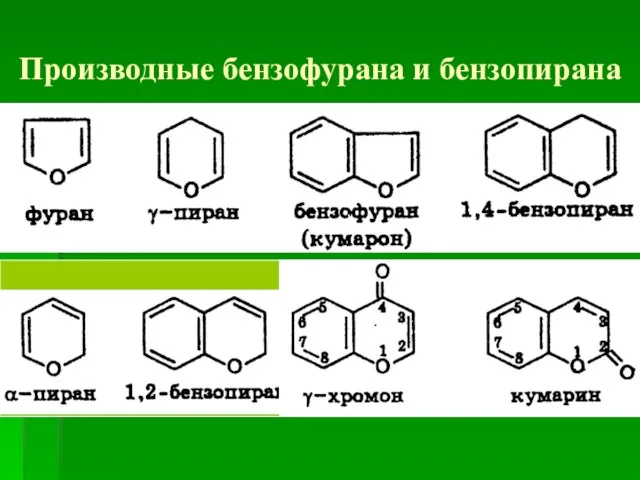
- 54. Производные бензофурана и бензопирана
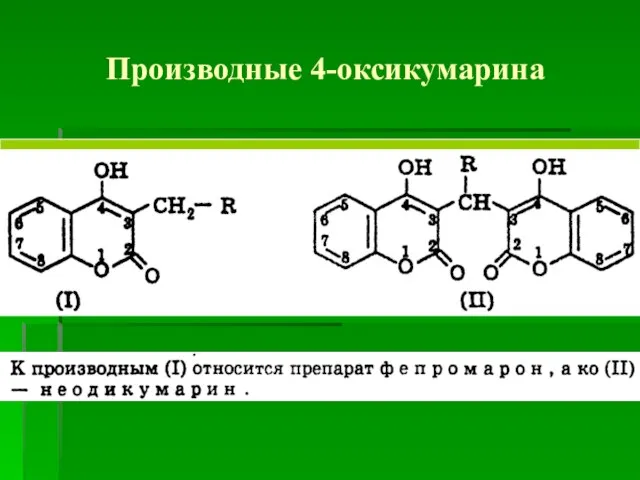
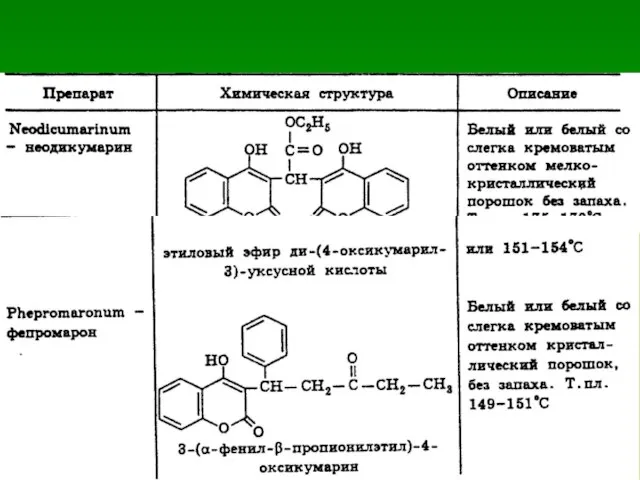
- 55. Производные 4-оксикумарина
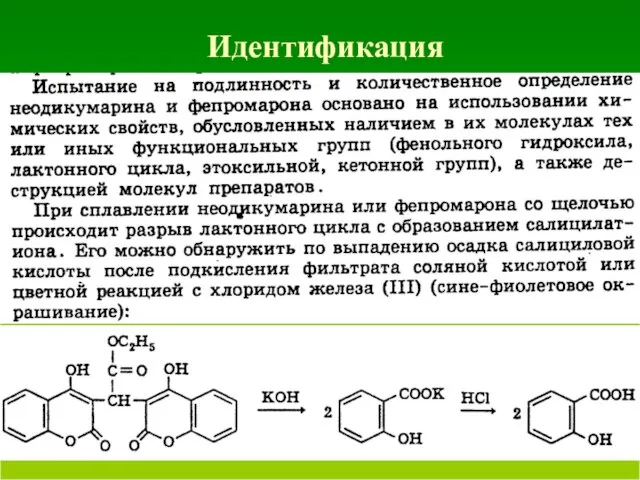
- 57. Идентификация
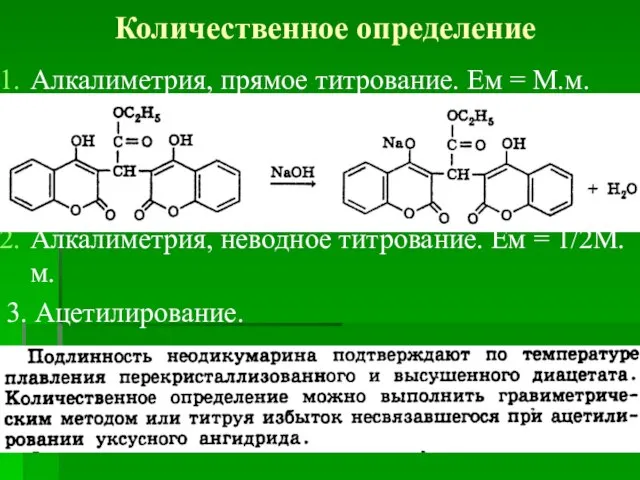
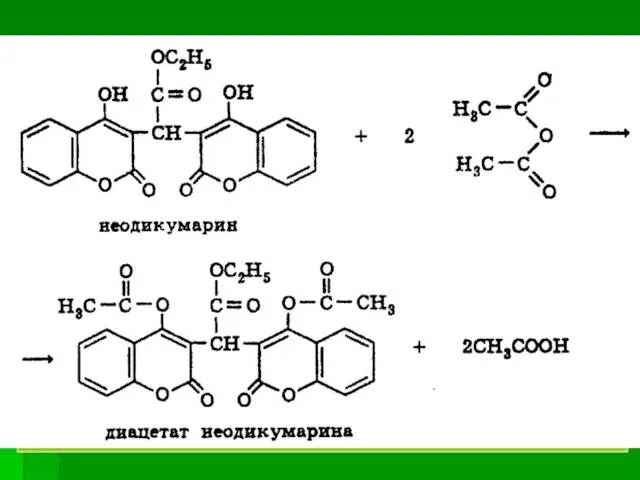
- 59. Количественное определение Алкалиметрия, прямое титрование. Ем = М.м. Алкалиметрия, неводное титрование. Ем = 1/2М.м. 3. Ацетилирование.
- 61. Хранение, применение Неодикумарин и фепромарон хранят по списку А в хорошо укупоренной таре, предохраняющей от действия
- 63. Скачать презентацию































 Газ тәрізді диэлектриктер. Пропан
Газ тәрізді диэлектриктер. Пропан Окисники, відновники
Окисники, відновники Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Vzácne plyny
Vzácne plyny Чистые вещества и смеси
Чистые вещества и смеси Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления Кислород
Кислород Введение. Основные понятия химии
Введение. Основные понятия химии 10_kl_klas-ya
10_kl_klas-ya Влияние давления на скорость химических реакций с участием газов
Влияние давления на скорость химических реакций с участием газов 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Счастливый случай
Счастливый случай ОВР
ОВР Основы химической термодинамики и термохимии. Лекция 3
Основы химической термодинамики и термохимии. Лекция 3 Загрязнение почв пестицидами
Загрязнение почв пестицидами Коды Менделеева
Коды Менделеева Химия – это наука о …
Химия – это наука о … Составьте формулы кислот
Составьте формулы кислот Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Идентификация Бензойной кислоты
Идентификация Бензойной кислоты Сульфиды (2)
Сульфиды (2) Бензол (Арены )
Бензол (Арены ) Непредельные углеводороды ряда этиленовых
Непредельные углеводороды ряда этиленовых Физические и химические свойства металлов
Физические и химические свойства металлов Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ
Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды