Содержание
- 2. Химические реакции Реакции разложения Реакции соединения Реакция замещения Реакции обмена
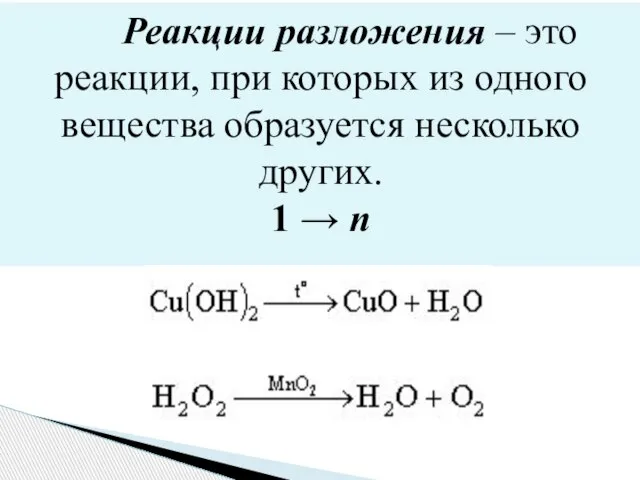
- 3. Реакции разложения – это реакции, при которых из одного вещества образуется несколько других. 1 → n
- 4. Вещества, изменяющие скорость реакции, но сами при этом не расходующиеся, называются катализаторами. Реакции, на скорость которых
- 5. Реакции соединения – это реакции, при которых из нескольких веществ образуется одно: n → 1. 4P
- 6. Реакция замещения – это реакция между простым и сложным веществом, при которой атомы простого вещества, замещают
- 7. Реакции обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями: CuSO4 +
- 8. Необратимые реакции – это реакции, которые при данных условиях идут только в одном направлении. Условиями необратимого
- 9. Обратимые реакции – реакции, которые при данных условиях протекают в двух противоположных направлениях. CuSO4 + 2NaCl
- 11. Скачать презентацию






 Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Свинец
Свинец Строение атома и ПСХЭ. Повторение 9 класс
Строение атома и ПСХЭ. Повторение 9 класс Применение алкинов
Применение алкинов Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1)
Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1) Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Реакции ионного обмена
Реакции ионного обмена Обобщение. Неметаллы
Обобщение. Неметаллы Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Кислоты
Кислоты Оптические свойства веществ
Оптические свойства веществ 1399920
1399920 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химия на войне
Химия на войне Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Графит (С)
Графит (С) Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения  Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Азот. Физические свойства азота
Азот. Физические свойства азота Химия в игре. Проектная работа
Химия в игре. Проектная работа Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Спирты
Спирты Изомерия
Изомерия Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот