Содержание
- 2. Цель урока научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономерные
- 6. Атом – наименьшая электронейтральная частица химического элемента, состоящая из ядра и электронной оболочки
- 8. Атом электронейтрален Число протонов (+) и число электронов (-) в атоме одинаково Их число соответствует порядковому
- 10. Электроны в атоме различаются своей энергией Электроны, двигаясь вокруг ядра атома, образуют в совокупности его электронную
- 11. Электронная оболочка (энергетический уровень) атома водорода состоит из … электрона атома хлора – из… электронов золота
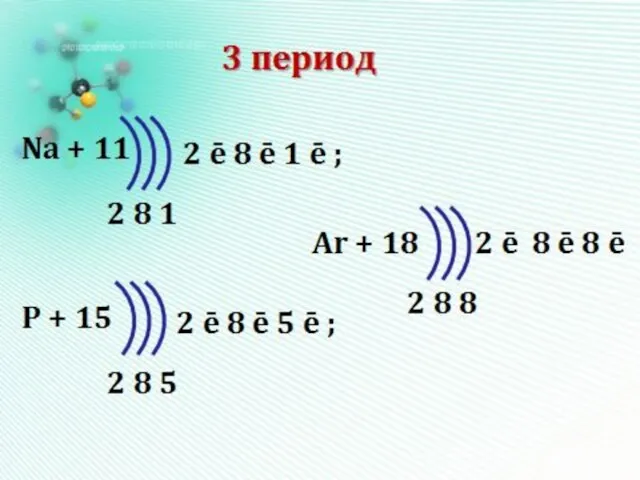
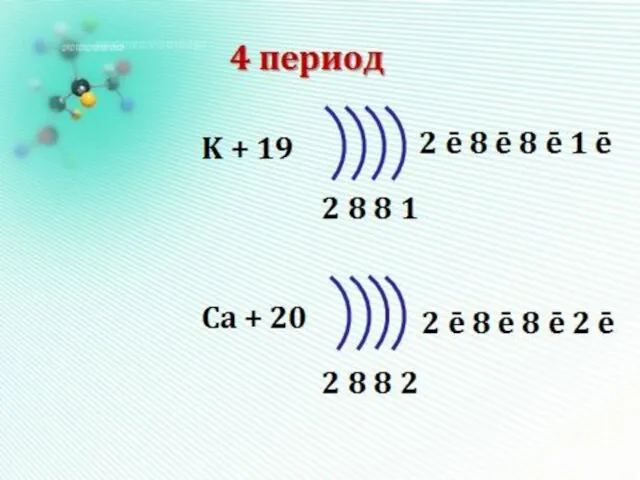
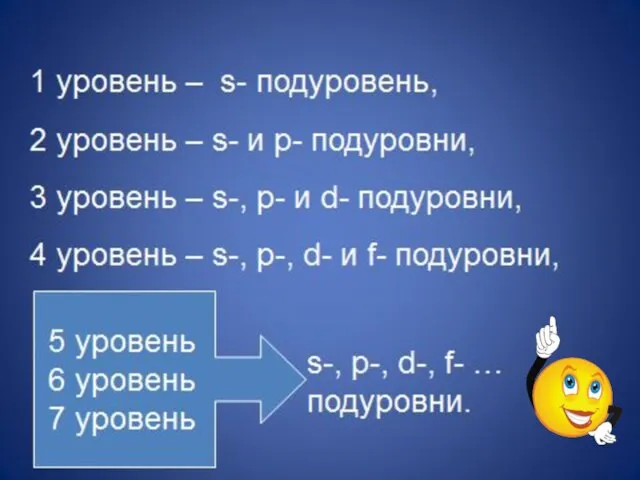
- 12. Число заполняемых электронами энергетических уровней в атоме равно номеру периода (n) в таблице Д.И. Менделеева, в
- 13. 1 период - один эн.уровень максимум 2*12=2 e- 2 период - два э.уровня максимум 2*22=8 e-
- 14. Энергетические уровни, содержащие максимальное число электронов, называются завершенными
- 15. Число электронов на внешней оболочке определяется номером группы, в которой находится химический элемент (не может быть
- 16. 1. Записываем знак химического элемента и заряд ядра его атома – он равен порядковому номеру элемента.
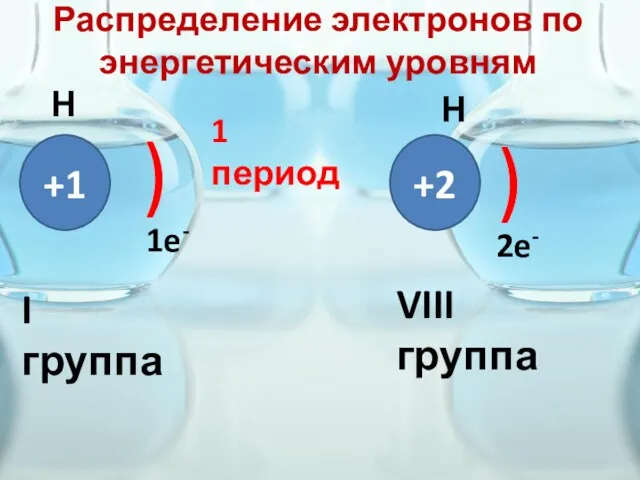
- 17. Распределение электронов по энергетическим уровням +1 ) 1e- Н Не +2 ) 2e- 1 период I
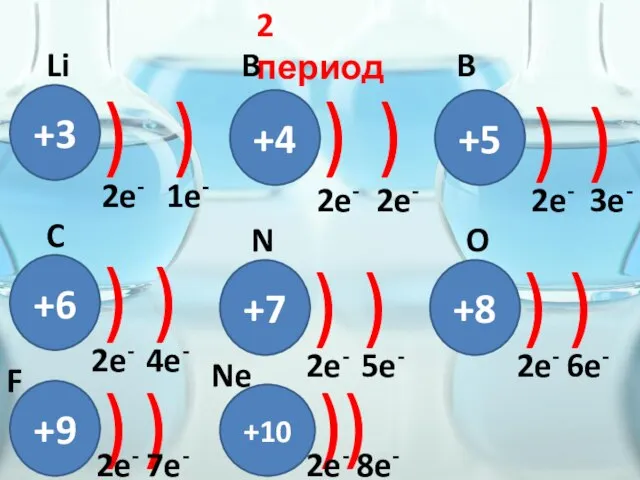
- 18. 2 период +3 ) ) 2e- 1e- Li Bе +4 ) ) 2e- 2e- B +5
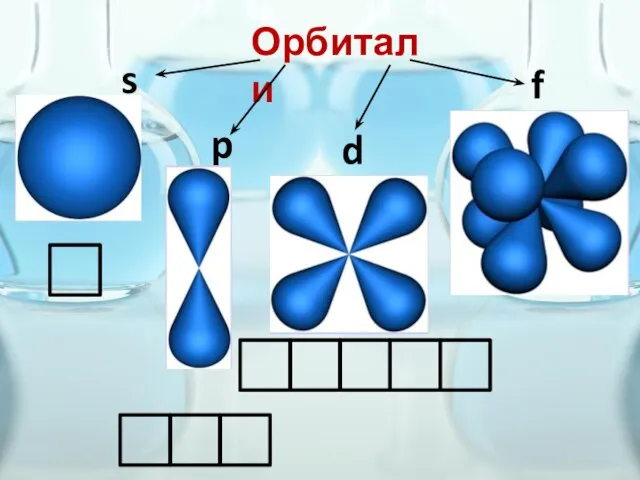
- 21. Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называют орбиталью этого электрона или электронным
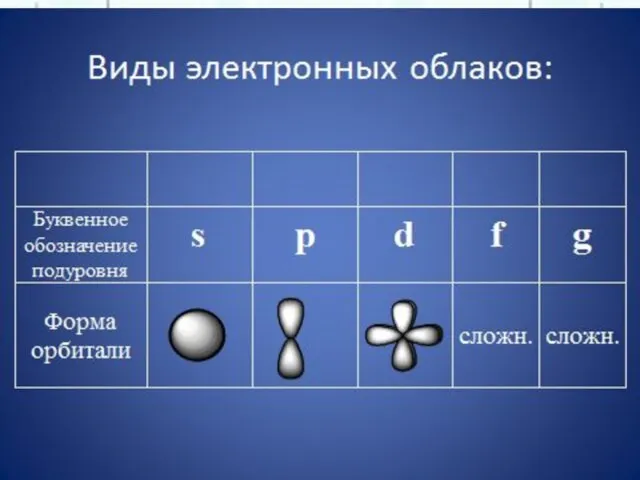
- 22. Орбитали s f p d
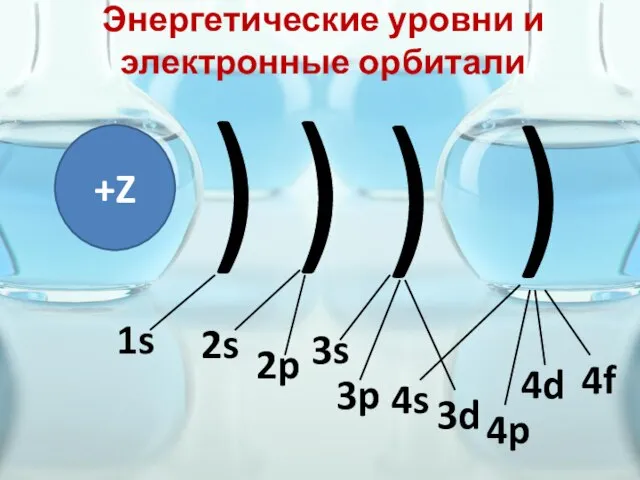
- 24. Энергетические уровни и электронные орбитали +Z ) ) ) ) 1s 2s 2p 3s 3p 3d
- 26. ИТАК, имеем 1s 2s2p3s3p3d 4s4p4d4f 5s5p5d5f… 6s6p6d6f… 7s7p7d7f…
- 27. Распределение электронов по орбиталям 1. s-орбитали заполняются в первую очередь. Затем заполняются р-орбитали. 2. На каждой
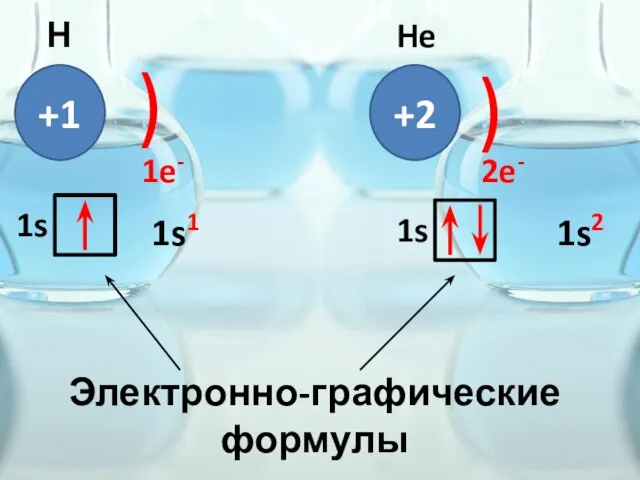
- 28. +1 ) 1e- Н 1s +2 ) He 2e- 1s Электронно-графические формулы 1s1 1s2
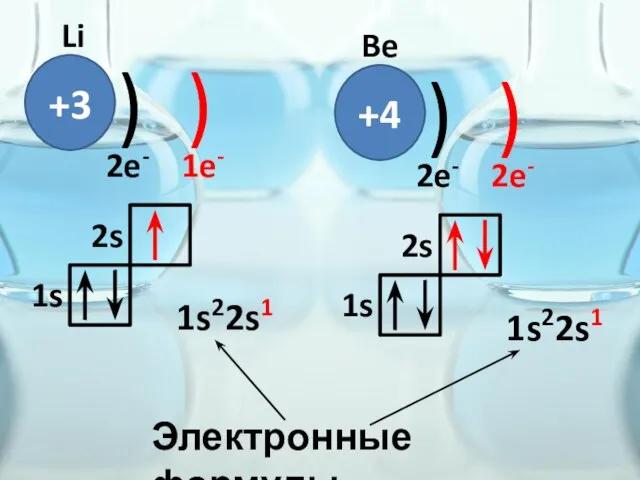
- 29. +3 ) ) Li 2e- 1e- 1s 2s +4 ) ) 2e- 2e- 1s 2s Be
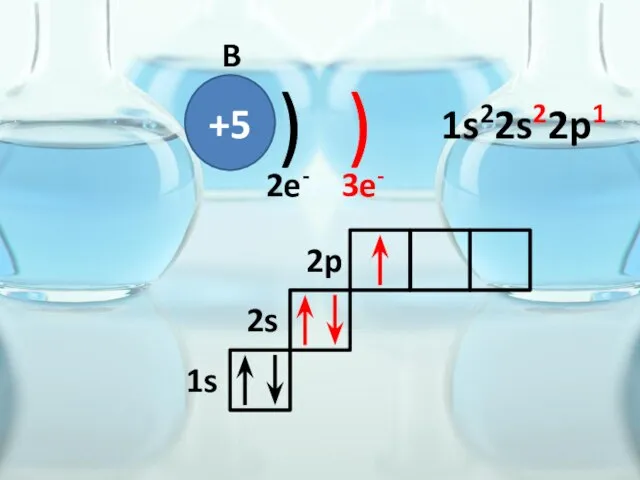
- 30. +5 ) ) B 2e- 3e- 1s 2s 2p 1s22s22p1
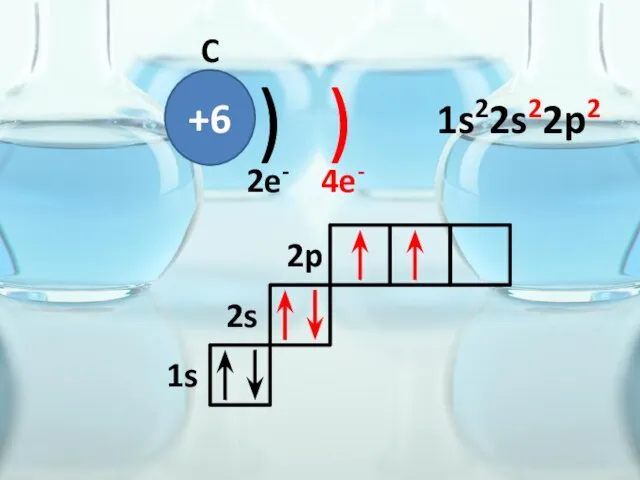
- 31. +6 ) ) C 2e- 4e- 1s 2s 2p 1s22s22p2
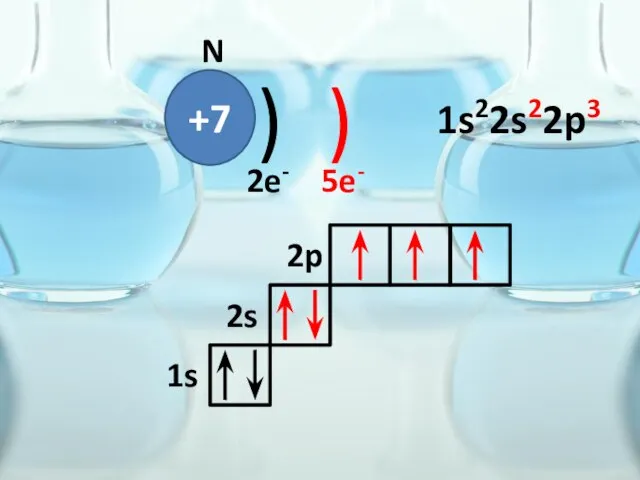
- 32. +7 ) ) N 2e- 5e- 1s 2s 2p 1s22s22p3
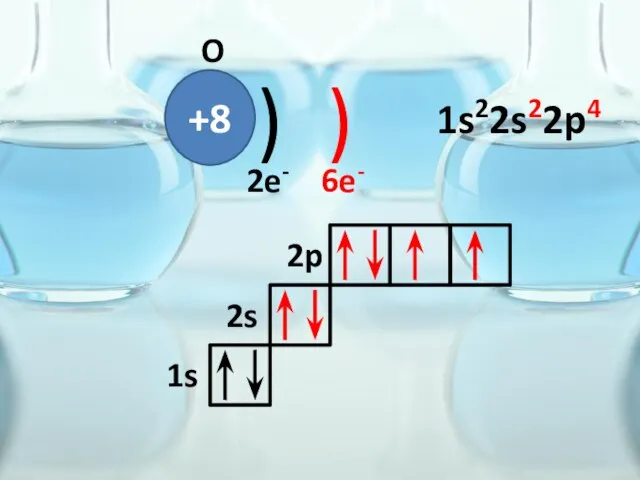
- 33. +8 ) ) O 2e- 6e- 1s 2s 2p 1s22s22p4
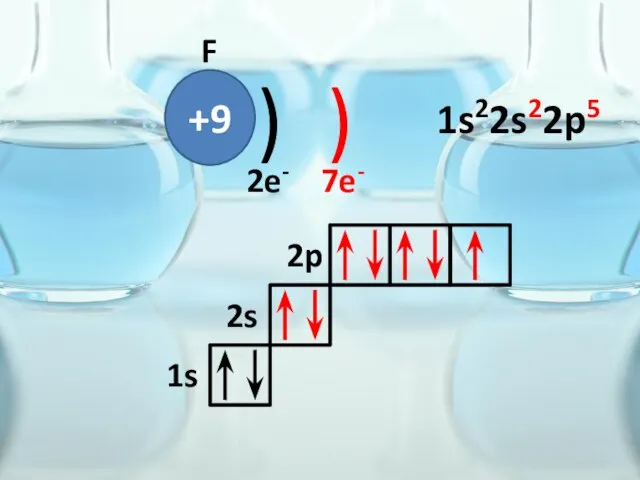
- 34. +9 ) ) F 2e- 7e- 1s 2s 2p 1s22s22p5
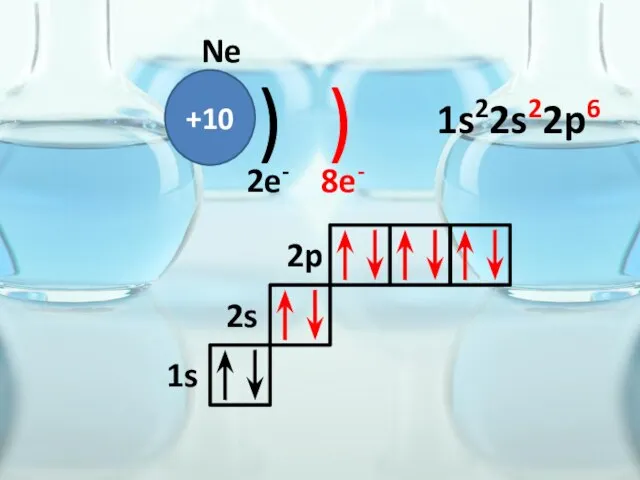
- 35. +10 ) ) Ne 2e- 8e- 1s 2s 2p 1s22s22p6
- 38. Домашнее задание О.С. Габриелян: §9, упр. 1-4 стр. 60. О.С. Габриелян и другие: §31, упр. 3-6
- 41. Скачать презентацию






















 Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Презентация на тему Обобщение по типам химических реакций
Презентация на тему Обобщение по типам химических реакций  Dereglarea metabolismului
Dereglarea metabolismului Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Действие активированного угля
Действие активированного угля Метод валентных связей
Метод валентных связей Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Галогены
Галогены Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник" 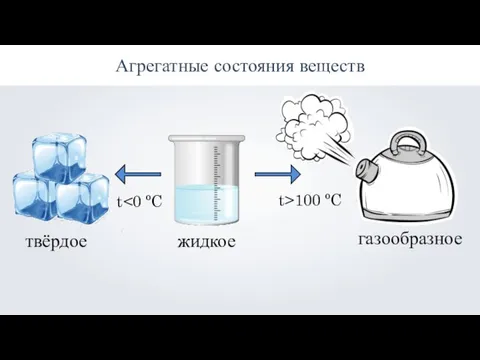 Агрегатные состояния веществ: твёрдое, жидкое, газообразное
Агрегатные состояния веществ: твёрдое, жидкое, газообразное 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 8-9-10 химические формулы
8-9-10 химические формулы Кислоты и их свойства
Кислоты и их свойства Сложные эфиры. Жиры
Сложные эфиры. Жиры Презентация на тему ОВР в органической химии 11 класс
Презентация на тему ОВР в органической химии 11 класс  Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Периодическая система
Периодическая система Салқындатқыш агенттер
Салқындатқыш агенттер Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Горные породы
Горные породы Стереоизомерия
Стереоизомерия Многоатомные спирты
Многоатомные спирты