Содержание
- 2. NH3 N2 N2O NO HNO2 NO2 HNO3 Степень окисления — это условный заряд атомов химического элемента
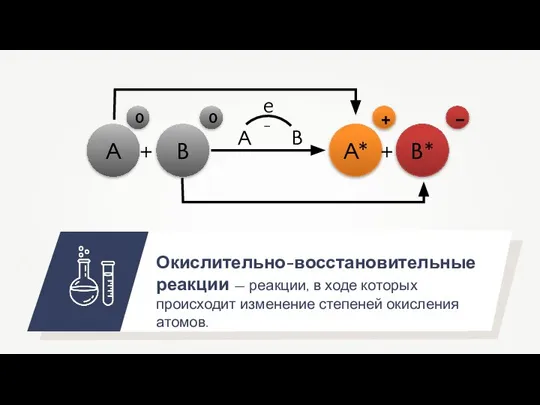
- 3. Окислительно-восстановительные реакции — реакции, в ходе которых происходит изменение степеней окисления атомов. A B A* B*
- 4. Правила расчёта степеней окисления +2
- 5. Лабораторный способ получения водорода Zn + 2HCl = Zn + 2Cl2 + H2 +1 0 -1
- 6. Реакции горения углеводородов протекают с изменением степеней окисления атомов элементов.
- 7. Горение этана 2С2Н6 + 7О2 → 4СО2 + 6Н2О +1 -4 0 -2 +1 +4 Окислитель
- 8. Сильные восстановители Сильные окислители – водород – углерод – сероводород – аммиак – металлы – кислород
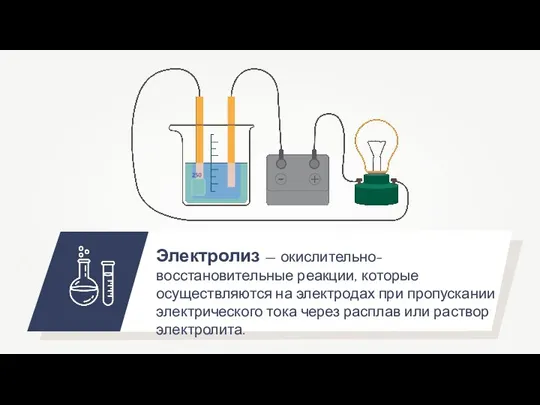
- 9. Электролиз — окислительно-восстановительные реакции, которые осуществляются на электродах при пропускании электрического тока через расплав или раствор
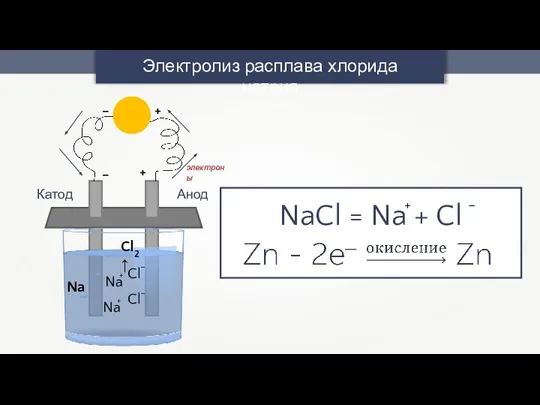
- 10. Электролиз расплава хлорида натрия + – + – Анод Катод Cl2↑ Na электроны
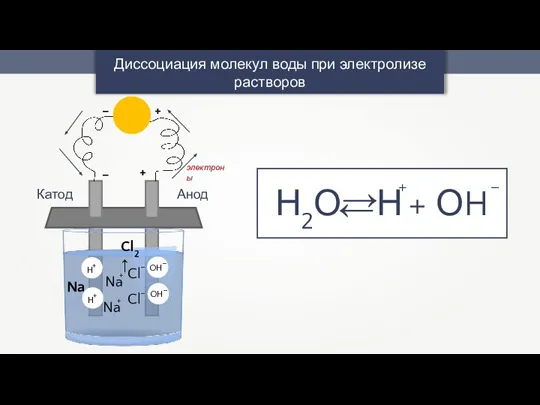
- 11. Диссоциация молекул воды при электролизе растворов Н2О Н + ОH + – + – + –
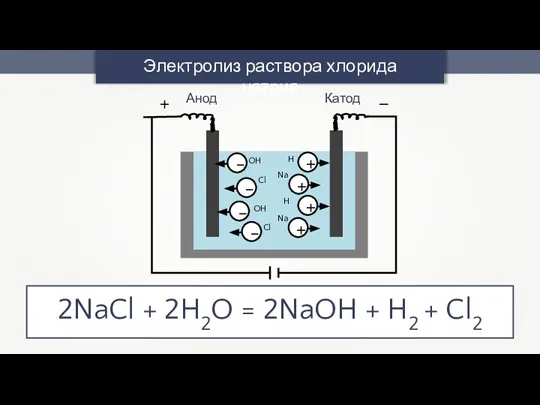
- 12. Электролиз раствора хлорида натрия OH OH Cl Na Na Cl H H Анод Катод + –
- 13. Практическое промышленное применение электролиза
- 14. Практическое промышленное применение электролиза
- 16. Скачать презентацию








 Фосфор. Тест по химии для 9 класса
Фосфор. Тест по химии для 9 класса Дигибридное скрещивание.Третий закон Г.Менделя.
Дигибридное скрещивание.Третий закон Г.Менделя. Углеводороды
Углеводороды Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Ароматические углеводороды
Ароматические углеводороды Алкены
Алкены Основания, их состав и название
Основания, их состав и название Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Спирты
Спирты Получение волокон на основе сверхвысокомолекулярного полиэтилена
Получение волокон на основе сверхвысокомолекулярного полиэтилена Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Полиморфизм. Аморфные вещества
Полиморфизм. Аморфные вещества Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Основы квантовой химии
Основы квантовой химии Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс Лучший тест для подготовки к ЕГЭ по химии
Лучший тест для подготовки к ЕГЭ по химии Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Парафины или алканы. Циклоалканы или нафтены
Парафины или алканы. Циклоалканы или нафтены Тест для подготовки к ГИА по химии
Тест для подготовки к ГИА по химии Щелочноземельные металлы
Щелочноземельные металлы Превращения веществ
Превращения веществ Задания для подготовки к ЕГЭ по химии
Задания для подготовки к ЕГЭ по химии ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски