Содержание
- 2. Сера. Характеристика химического элемента и простого вещества
- 3. Закрепим умения 1.характеризовать: - элементы по ПС -Состав атома -строение атома -окислительно-восстановительные свойства 2.Составлять ОВР с
- 4. Узнаем: -аллотропные модификации серы -нахождение серы в природе -физические свойства серы -химические свойства -применение серы
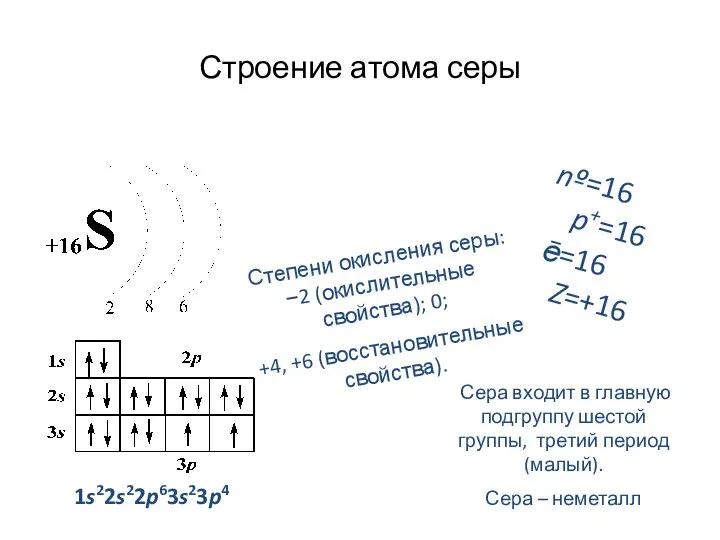
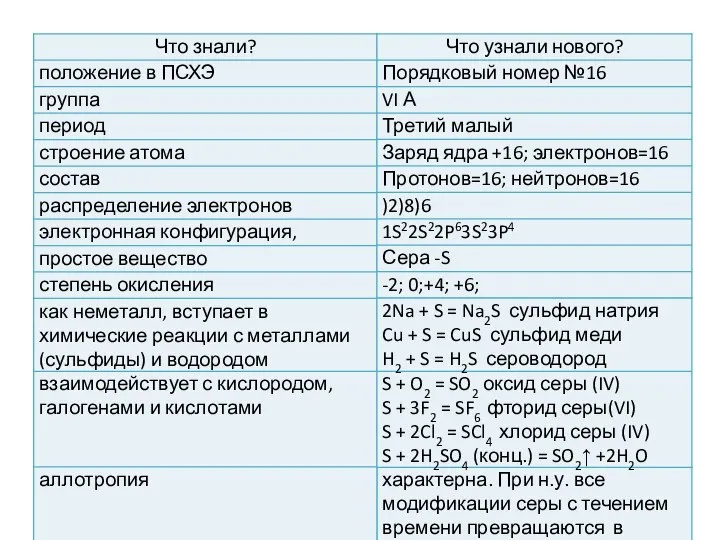
- 5. Строение атома серы 1s22s22p63s23p4 nº=16 p+=16 ē=16 Z=+16 Сера входит в главную подгруппу шестой группы, третий
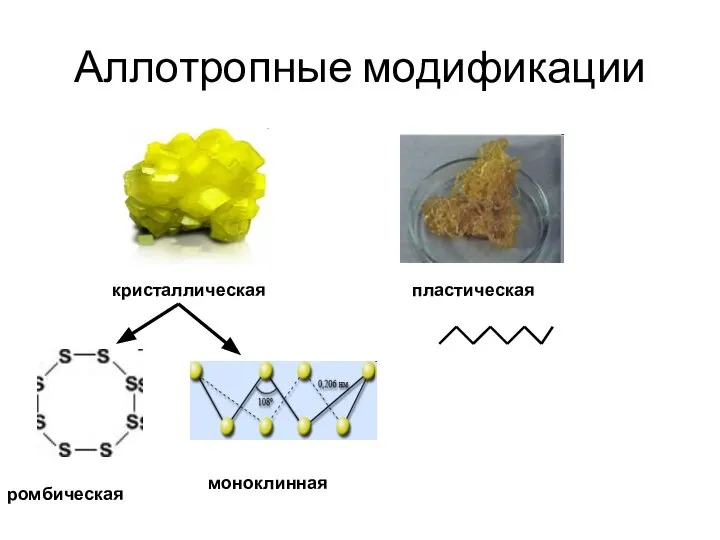
- 6. Аллотропные модификации кристаллическая пластическая ромбическая моноклинная
- 7. Кристаллическая, пластическая и моноклинная сера
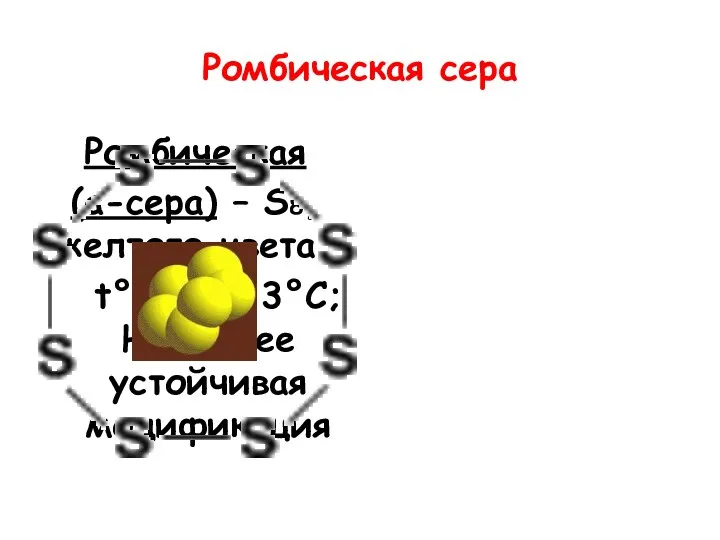
- 8. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
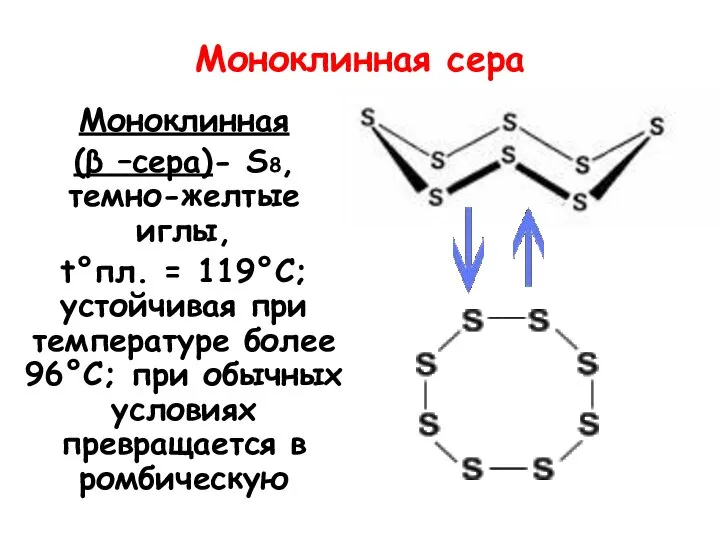
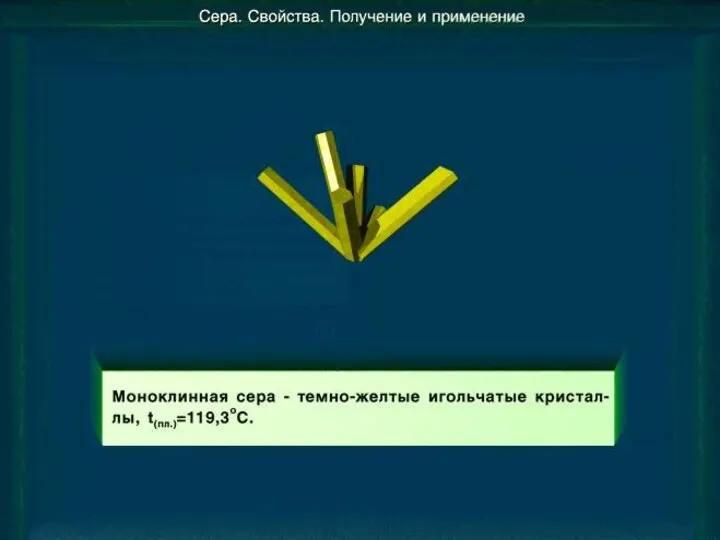
- 10. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
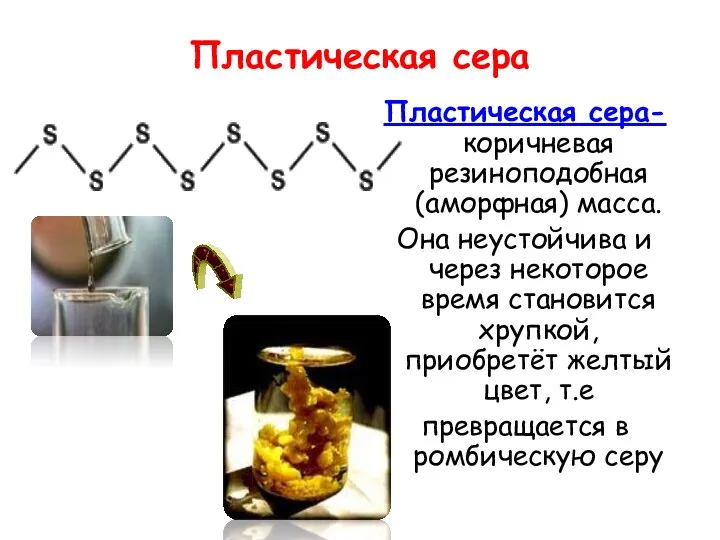
- 12. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
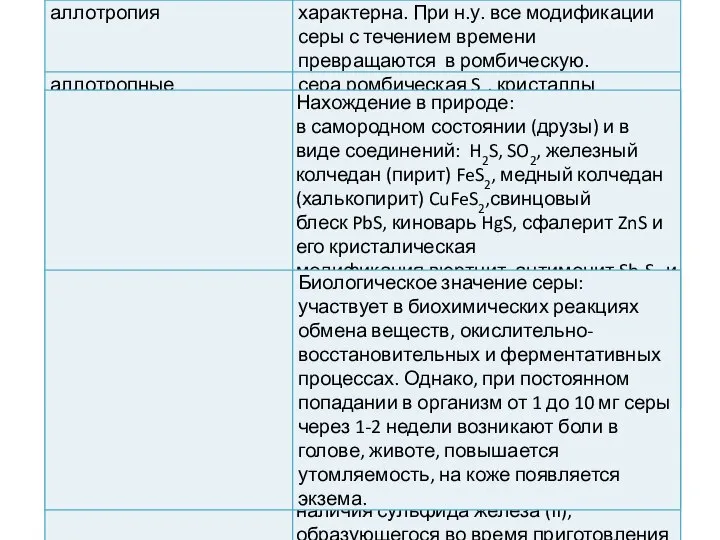
- 14. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
- 15. Сера в природе Самородная Сульфидная: Сероводород H2S Цинковая обманка ZnS Киноварь HgS Свинцовый блеск PbS Пирит
- 16. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 17. Пирит – «огненный камень» (соединение серы в природе)
- 18. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера
- 19. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
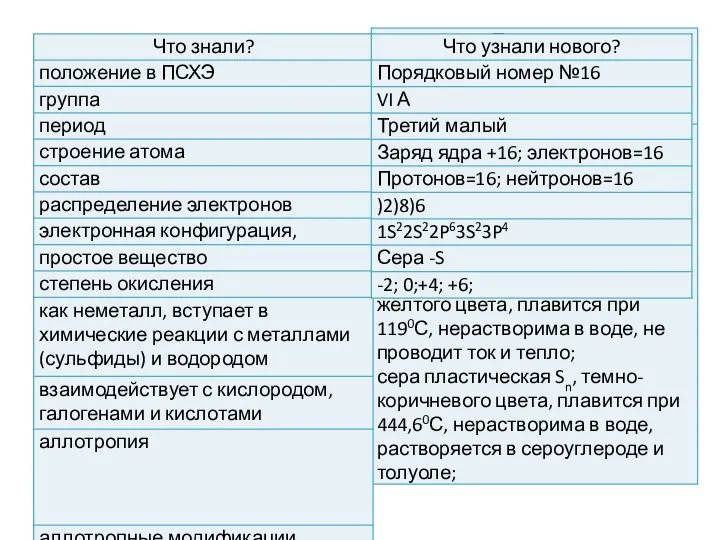
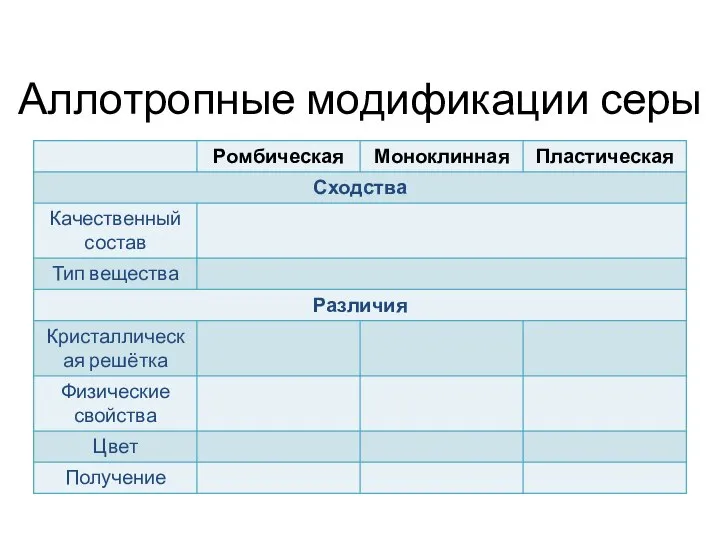
- 20. Концептуальная таблица
- 22. Аллотропные модификации серы
- 23. Сера Химические свойства
- 24. Примеры химических реакций S + O2 = SO2 Zn + S = ZnS 2Na + S
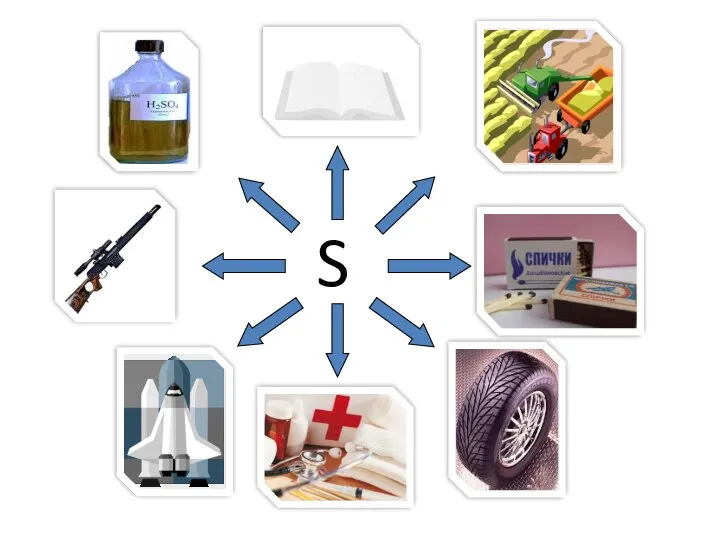
- 27. Сера Применение
- 28. S
- 30. Что вам на уроке удалось лучше всего? Что вам понравилось на уроке? С каким настроением заканчиваете
- 32. Скачать презентацию
















 Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1 Искусство фотографии и химия
Искусство фотографии и химия Analysis of proteins
Analysis of proteins Задачи химической кинетики
Задачи химической кинетики Железо и его соединения
Железо и его соединения Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Направление процесса. ОВР
Направление процесса. ОВР Синтез 7,7 - дихлоробицикло [4.1.0] гептана
Синтез 7,7 - дихлоробицикло [4.1.0] гептана Кремний и 4 группа. 9 класс
Кремний и 4 группа. 9 класс Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Газовые смеси. Способы задания газовых смесей. Лекция 5
Газовые смеси. Способы задания газовых смесей. Лекция 5 Структура периодической таблицы
Структура периодической таблицы Обобщение знаний по теме атомы химических элементов. Химическая связь
Обобщение знаний по теме атомы химических элементов. Химическая связь Презентация на тему Аминокислоты и белки: строение и свойства
Презентация на тему Аминокислоты и белки: строение и свойства  Железо в продуктах питания
Железо в продуктах питания Производство аммиака
Производство аммиака Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов kristallichekaya_reshenka_vidy
kristallichekaya_reshenka_vidy Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Сравнение активностей металлов
Сравнение активностей металлов Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Кислоты с металлами
Кислоты с металлами Многообразие веществ
Многообразие веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики