Содержание
- 2. Литература 1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа, 2007. -976 с. 2.Пузаков
- 3. 5.Биоорганическая химия. Учебник. (Тюкавкина Н.А., Бауков Ю.И.). 7 изд., Дрофа. 2008 – 543 с. 6.Руководство к
- 4. Интернет-источники http://www.chem.msu.su http://www.xumuk.ru/ http://www.alhimik.ru/ http://www.chemlib.ru http://alhimikov.net/ http://chemistry.narod.ru/ http://www.chemport.ru/
- 5. Значение химии в медицине 1.78 химических элементов входят в состав живых организмов. 2.44 элемента входят в
- 6. Задача, стоящая перед медиками в ближайшее время, предупреждать, а не лечить болезни. Чтобы стать высококвалифицированным специалистом
- 7. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
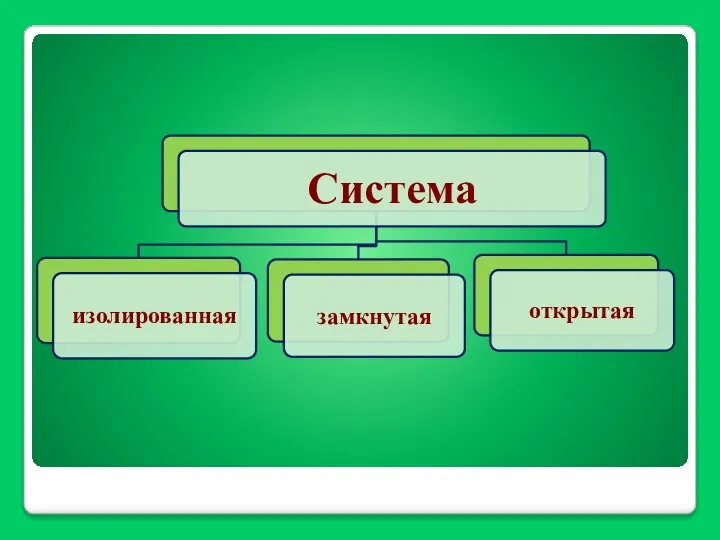
- 8. Термодинамика – наука, изучающая общие законы взаимного превращения одной формы энергии в другую. Система – это
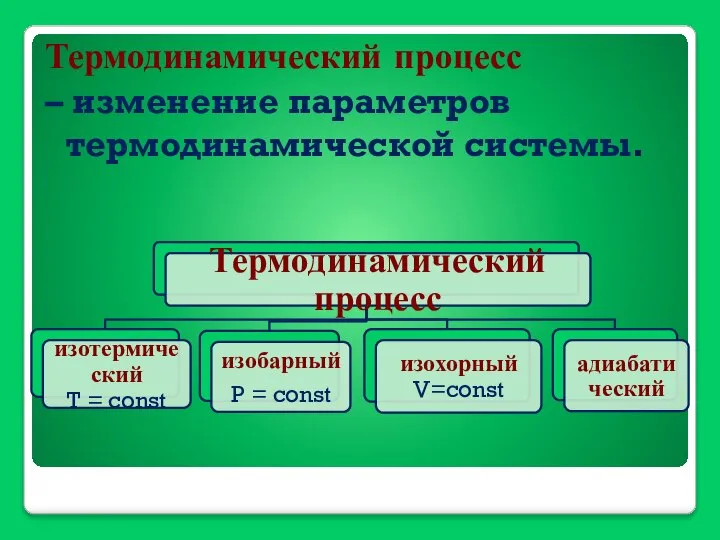
- 11. Термодинамический процесс – изменение параметров термодинамической системы.
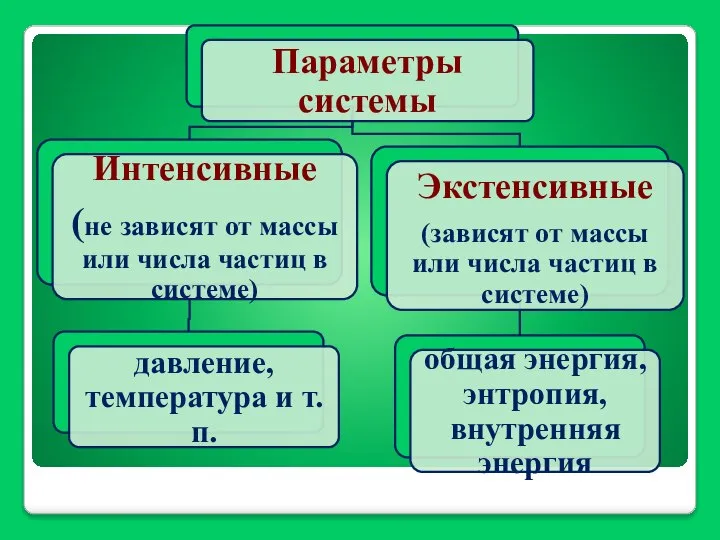
- 12. Энергия системы (W) - совокупность двух частей: зависящей от движения и положения системы как целого (Wц)
- 13. Внутренняя энергия разделяется на свободную энергию и связанную энергию: U = G + Wсв Свободная энергия
- 14. При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы
- 15. Энергия расширенной системы, или внутреннее теплосодержание системы называется энтальпией (Н). Для экзотермических реакций Q>0, ΔH Для
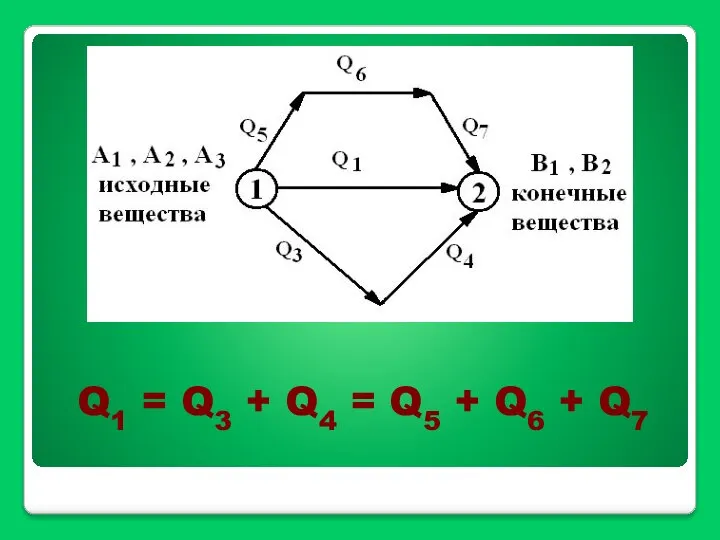
- 16. Q1 = Q3 + Q4 = Q5 + Q6 + Q7
- 17. I следствие закона Гесса где νн, νк - стехиометрические коэффициенты для реакции аА + bB→dD ∆Hреакц.
- 18. Величина и знак теплоты образования характеризуют устойчивость соединения в данных условиях Вещество NH3 PH3 AsH3 SbH3
- 19. Энтропия (S) - функция состояния термодинамической системы, используемая во втором законе т/д для выражения через нее
- 20. ΔG – изобарно-изотермический потенциал (свободная энергия Гиббса) ΔG = ΔH – T · ΔS где ΔH
- 21. Особенности живых организмов с позиции термодинамики 1.Живой организм – открытая система, непрерывно обменивающаяся с окружающей средой
- 22. 3. Все биохимические процессы, происходящие в клетках живых организмов, протекают при постоянной температуре, давлении, при незначительных
- 23. Главными компонентами пищи являются углеводы, жиры и белки. Калорийность, то есть энергия, выделяемая в процессе диссимиляции
- 25. Скачать презентацию


















 Svins. Iegūšana
Svins. Iegūšana Prezentatsia1_1
Prezentatsia1_1 Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Степень окисления
Степень окисления Строение и функции нуклеиновых кислот. Лекция №3
Строение и функции нуклеиновых кислот. Лекция №3 Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Белки. Тест
Белки. Тест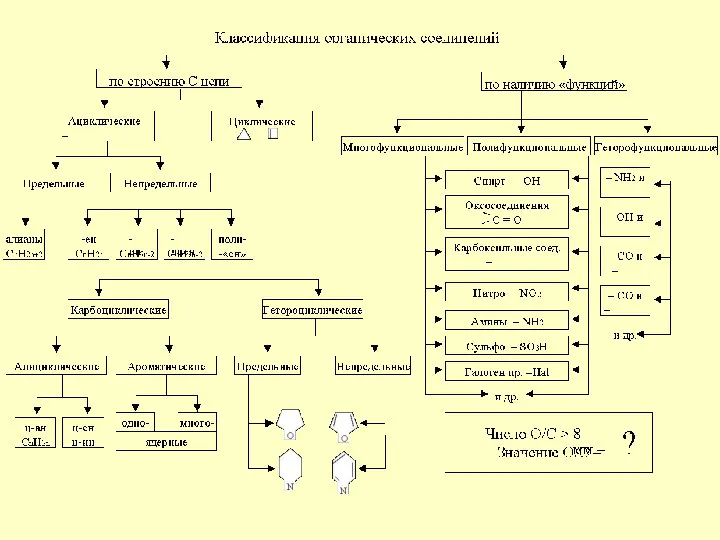 Классификация органических соединений
Классификация органических соединений Газовые законы
Газовые законы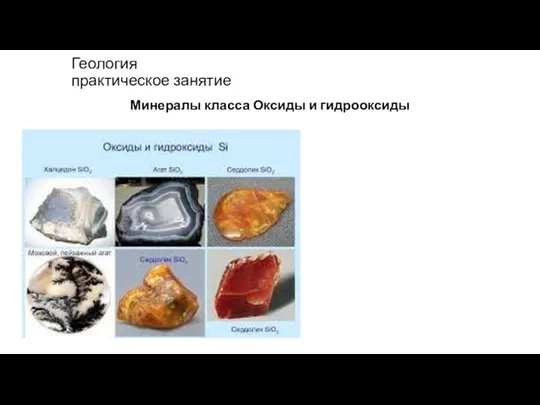 Оксиды и гидрооксиды
Оксиды и гидрооксиды Химическая связь
Химическая связь Ферментативная кинетика
Ферментативная кинетика Периодическая система химических элементов Д.И.Менделеева I
Периодическая система химических элементов Д.И.Менделеева I Выход продуктов пиролиза бензина
Выход продуктов пиролиза бензина Презентация на тему Производство чугуна и стали
Презентация на тему Производство чугуна и стали  Понятие биотехнологии
Понятие биотехнологии Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate Алмазы
Алмазы Комплексные соединения
Комплексные соединения История открытия водорода. Получение и физические свойства водорода
История открытия водорода. Получение и физические свойства водорода Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода
Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Алюминий
Алюминий Карбонат калия K2CO3
Карбонат калия K2CO3 Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Основы химической термодинамики и термохимии
Основы химической термодинамики и термохимии Определение Кофеина в Кофе
Определение Кофеина в Кофе