Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия
Содержание
- 2. Лекция 1. Строение атома углерода. Гибридизация. Номенклатура и изомерия.
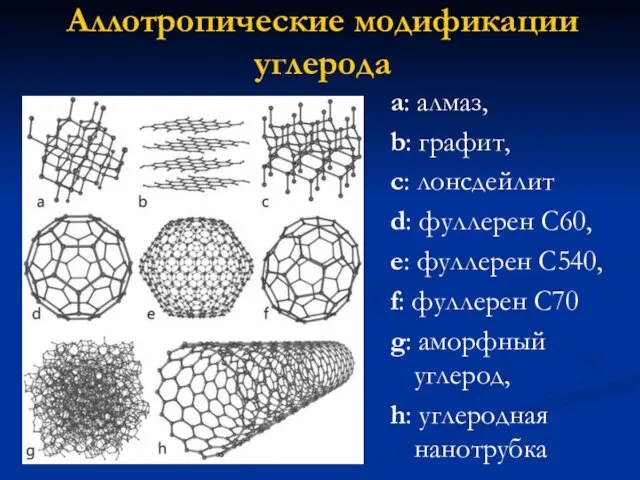
- 3. a: алмаз, b: графит, c: лонсдейлит d: фуллерен C60, e: фуллерен C540, f: фуллерен C70 g:
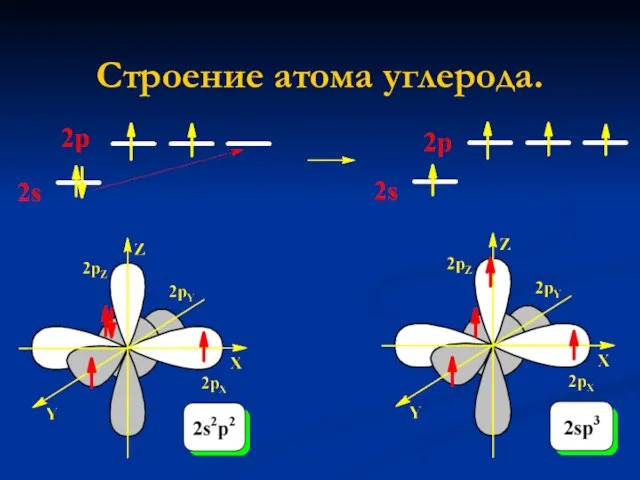
- 4. Строение атома углерода.
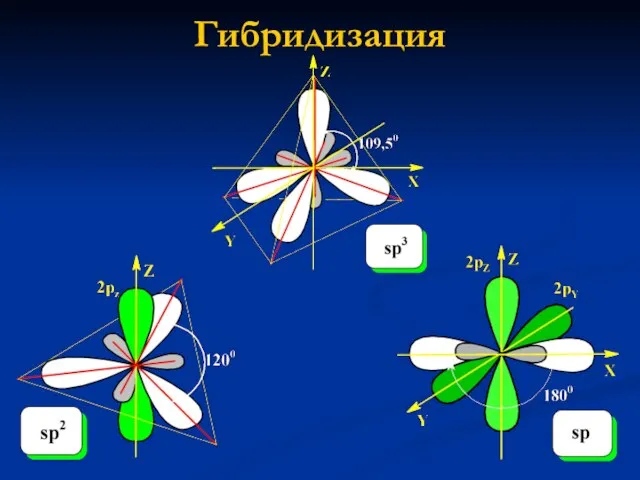
- 5. Гибридизация
- 6. Номенклатура органических соединений
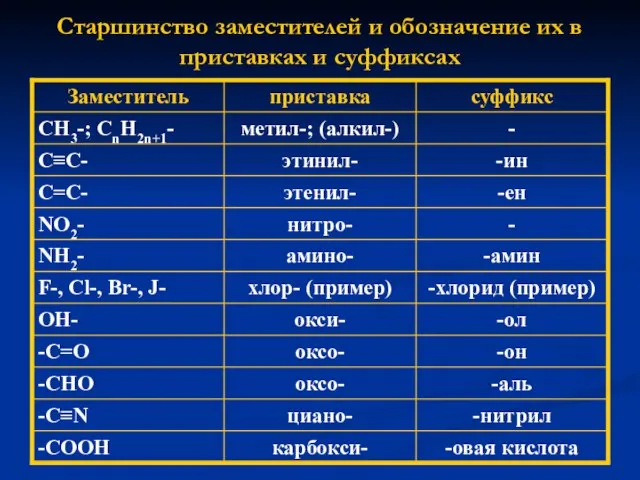
- 7. Старшинство заместителей и обозначение их в приставках и суффиксах
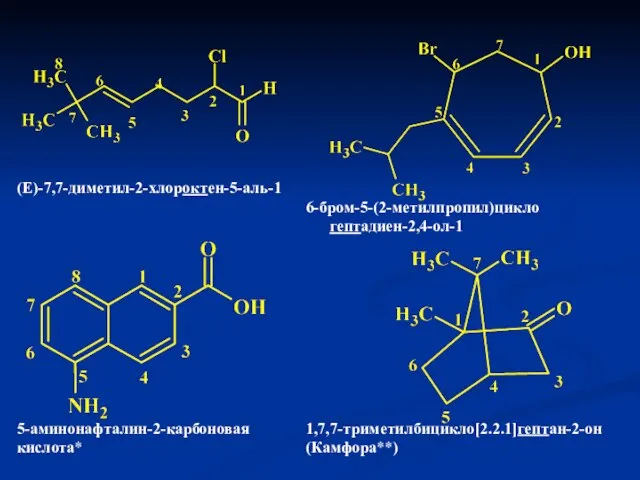
- 8. Правила IUPAC Выбирается самая длинная углеродная цепь, содержащая наибольшее количество разветвлений и заместителей и называется отдельно
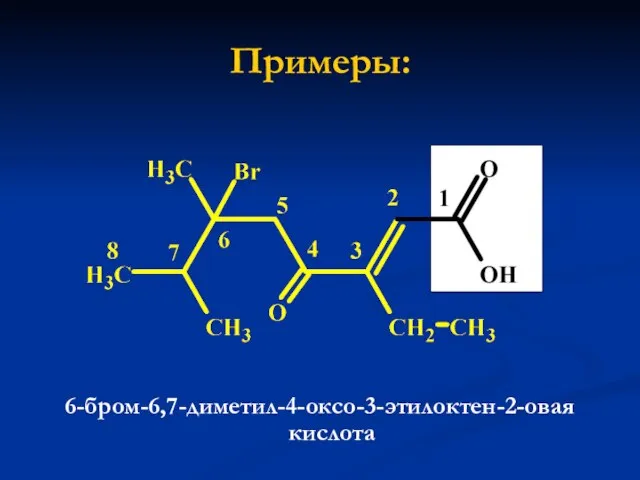
- 9. Примеры: 6-бром-6,7-диметил-4-оксо-3-этилоктен-2-овая кислота
- 11. Типы реакций в органической химии
- 12. Типы химических связей Ковалентная неполярная Ковалентная полярная Ионная Металлическая Водородная Взаимодействия Ван-дер-Ваальса
- 13. Химическая связь – явление перераспределения электронной плотности валентных электронов. Из отдельных атомных орбиталей (АО) образуются молекулярные
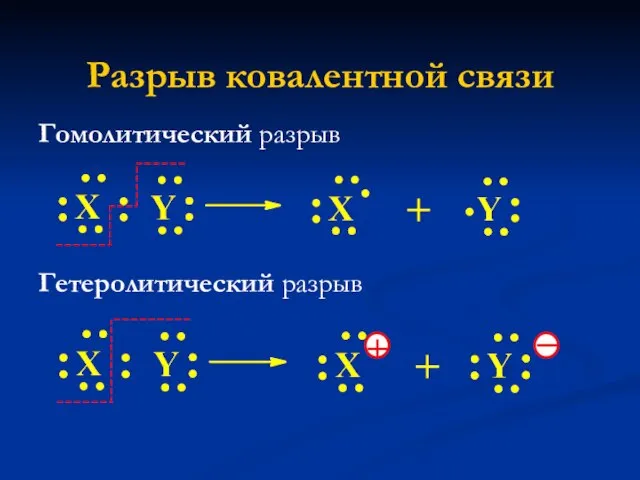
- 14. Разрыв ковалентной связи Гомолитический разрыв Гетеролитический разрыв
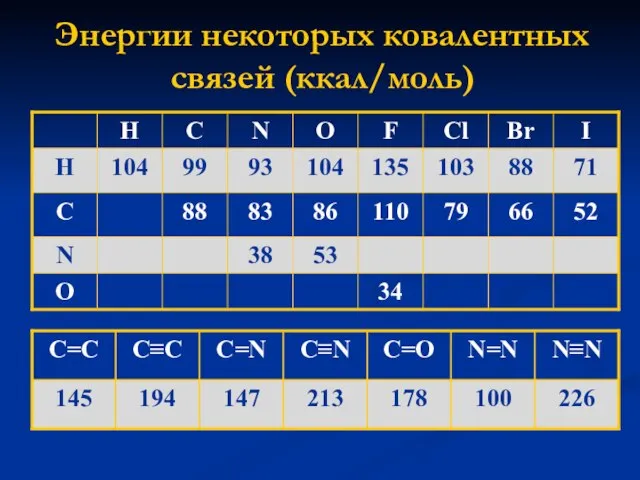
- 15. Энергии некоторых ковалентных связей (ккал/моль)
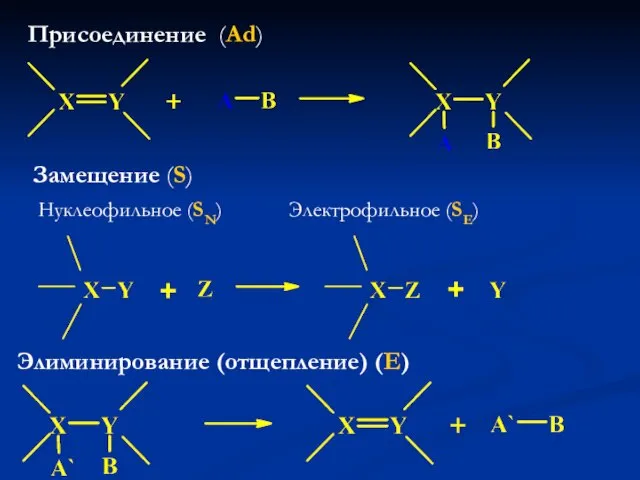
- 16. Присоединение (Ad) Замещение (S) Нуклеофильное (SN) Электрофильное (SE) Элиминирование (отщепление) (E)
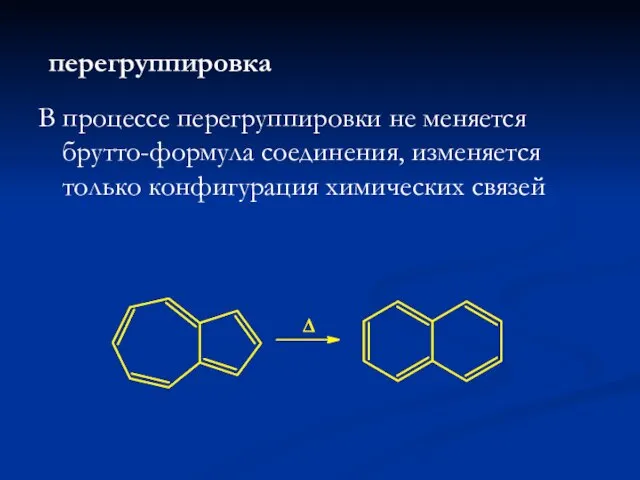
- 17. перегруппировка В процессе перегруппировки не меняется брутто-формула соединения, изменяется только конфигурация химических связей
- 18. Изомерия.
- 19. 1. Изомерия классов соединений. Физические (температуры кипения и плавления, теплоемкость, плотность и т.п.) и химические свойства
- 20. 2. Изомерия положения заместителей. Физические свойства различны, многие химические свойства близки, но существуют различия в реакционной
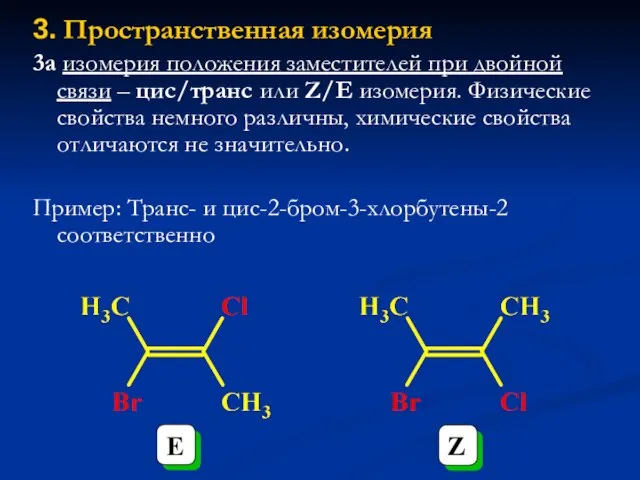
- 21. 3. Пространственная изомерия 3а изомерия положения заместителей при двойной связи – цис/транс или Z/E изомерия. Физические
- 22. Определение Z/E конфигурации двойной связи в молекуле Принадлежность к Z или E ряду определяется старшинством пар
- 23. Правила определения старшинства заместителей КИП. рассматривают атомы непосредственно связанные с углеродом кратной связи. Старшим считается атом
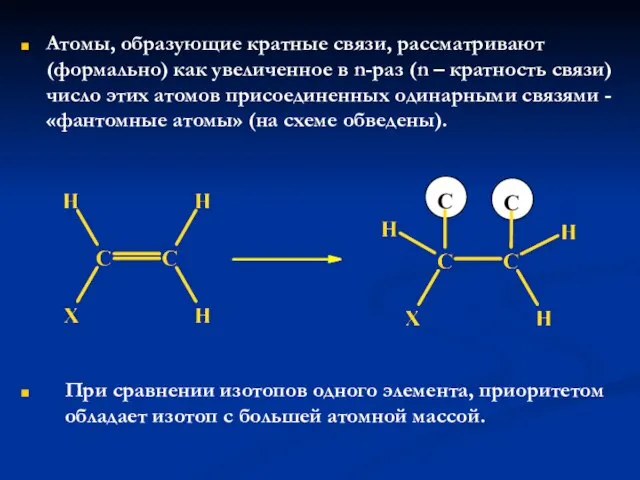
- 24. Атомы, образующие кратные связи, рассматривают (формально) как увеличенное в n-раз (n – кратность связи) число этих
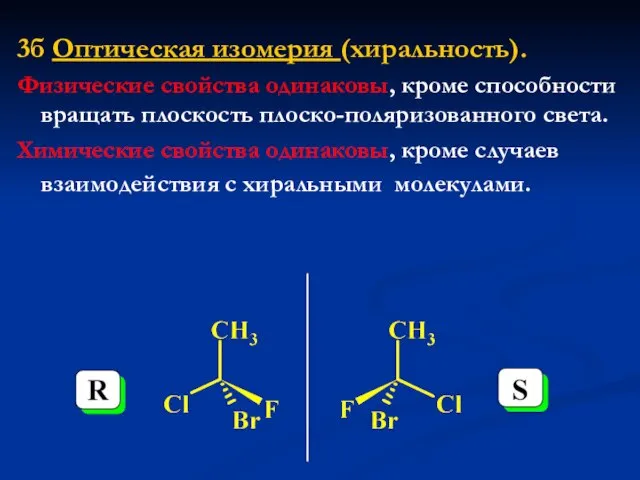
- 25. 3б Оптическая изомерия (хиральность). Физические свойства одинаковы, кроме способности вращать плоскость плоско-поляризованного света. Химические свойства одинаковы,
- 26. Определение R/S конфигурации хирального центра По правилам номенклатуры IUPAC абсолютные конфигурации точечного оптического (хирального) центра определяют
- 27. Большинство органических молекул встречающихся в биологических объектах имеют один или несколько оптических (хиральных) центров. Причем, как
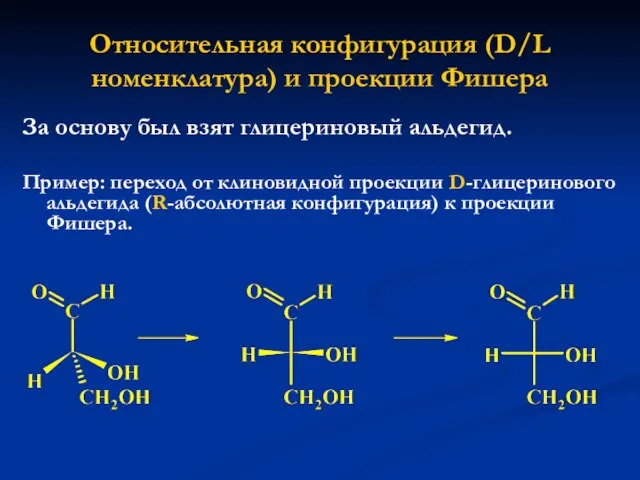
- 28. Относительная конфигурация (D/L номенклатура) и проекции Фишера За основу был взят глицериновый альдегид. Пример: переход от
- 30. Скачать презентацию













 Металлическая химическая связь
Металлическая химическая связь Буферные системы
Буферные системы Общая характеристика элементов подгруппы углерода. Углерод как простое вещество
Общая характеристика элементов подгруппы углерода. Углерод как простое вещество Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Что такое электрон?
Что такое электрон? Презентация на тему Жизнь и деятельность Д.И. Менделеева
Презентация на тему Жизнь и деятельность Д.И. Менделеева  Классификация неорганических веществ
Классификация неорганических веществ Формирование УУД на уроках химии
Формирование УУД на уроках химии Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации
Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения Lecture4-5
Lecture4-5 Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Полупроводниковые твердые растворы
Полупроводниковые твердые растворы Кислоты. Начальные сведения
Кислоты. Начальные сведения Уретановый каучук
Уретановый каучук Метелёва И.Е. учитель химии
Метелёва И.Е. учитель химии Оксиды и основания
Оксиды и основания Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Основные законы химии
Основные законы химии Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Методы анализа структуры белка
Методы анализа структуры белка Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Фенолы
Фенолы Задания по химии
Задания по химии Кислород
Кислород Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3