Содержание
- 2. Краткая характеристика элемента H 1 1,00794 1s1 Водород Водоро́д — первый элемент периодической системы элементов. Широко
- 3. Происхождение названия Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γενναω — «рождаю»)
- 4. Распространенность Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех
- 5. Химические свойства Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию,
- 6. Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3 С галогенами образует галогеноводороды: F2
- 7. Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na +
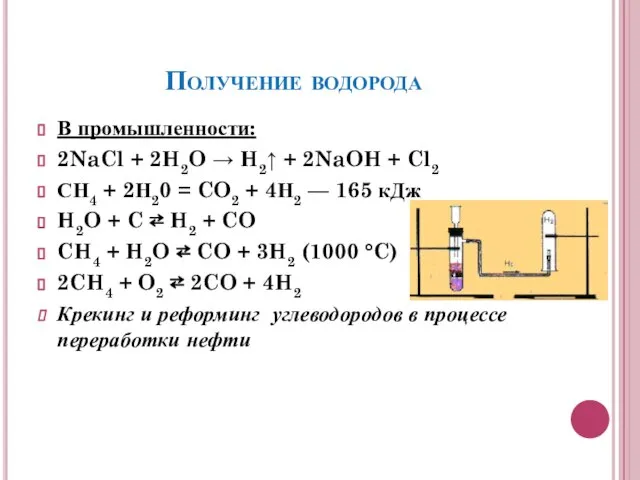
- 8. Получение водорода В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20
- 9. В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑
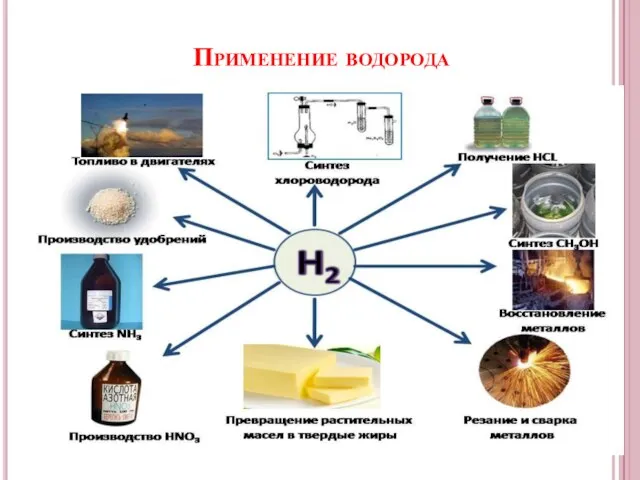
- 10. Применение водорода
- 12. Скачать презентацию







 Оксиды
Оксиды Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Презентация на тему Окислительно-восстановительные реакции: общие сведения
Презентация на тему Окислительно-восстановительные реакции: общие сведения  Альдегиды
Альдегиды Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии  строение атома
строение атома Углеводы
Углеводы Отжиг сталей (отжиг 2-го рода) Лекция 2
Отжиг сталей (отжиг 2-го рода) Лекция 2 Основной государственный экзамен Химия 2021
Основной государственный экзамен Химия 2021 Презентация на тему Атомы и молекулы
Презентация на тему Атомы и молекулы  Опыты с хондроитин сульфатом
Опыты с хондроитин сульфатом Kyseliny. Vlastnosti
Kyseliny. Vlastnosti Сказка о братьях карбонатах
Сказка о братьях карбонатах Оксиды, получение и свойства
Оксиды, получение и свойства ОВР
ОВР Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Определение формул органических веществ
Определение формул органических веществ Презентация на тему Концентрированная серная кислота
Презентация на тему Концентрированная серная кислота  Окисление этанола оксидом меди
Окисление этанола оксидом меди Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Горение и окисление Учитель: Какурин А.М.
Горение и окисление Учитель: Какурин А.М. Определение содержания витамина С в домашних условиях
Определение содержания витамина С в домашних условиях Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства
Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства Соль - без вины виновата
Соль - без вины виновата