Содержание
- 2. ПЛАН 1. Кинетика как наука. Основные понятия. 2. Факторы, влияющие на скорость: природа реагирующих веществ; концентрация,
- 3. Основные понятия кинетики Кинетика − раздел химии, изучающий механизмы химических реакций и скорости их протекания. Скорость
- 4. Основные понятия кинетики Для реакции в общем виде aA + bB → xX + yY скорость
- 5. Факторы, влияющие на скорость 1. Природа реагирующих веществ: определяется видом частиц (атомы, молекулы, ионы). 2. Концентрация
- 6. Факторы, влияющие на скорость 3. Температура: описывается правилом Вант-Гоффа Для химических реакций γ = 2-4, для
- 7. Основные положения теории активных соударений Для эффективного взаимодействия частицы должны: 1. столкнуться; 2. иметь благоприятную ориентацию;
- 8. Энергия активации , где Еа (кДж/моль) − энергия активации. Еа − минимальная энергия частиц, достаточная для
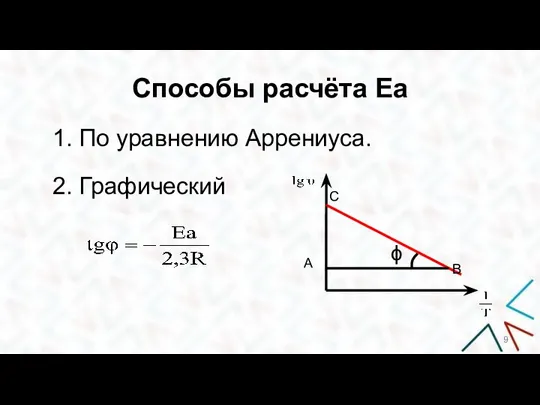
- 9. Способы расчёта Еа 1. По уравнению Аррениуса. 2. Графический
- 10. Молекулярность реакции Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из одного элементарного акта, называется
- 11. Порядок реакции − … … ∑ всех показателей степеней концентраций реагирующих веществ в ЗДМ. ; П
- 12. Кинетические уравнения для элементарных реакций 0, I и II порядка
- 13. Методы определения П 1. Метод изолирования Оствальда. 2. Метод подбора кинетических уравнений. 3. Графический tgϕ =
- 14. Методы определения П 4. По периоду полупревращения а) реакция I порядка: С0↑, τ const б) реакция
- 15. 4. Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν — разрушение) — явление изменения скорости химической или
- 16. Катализа́тор — … …вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. В отношении катализатора
- 17. Виды катализа 1. Гомогенный катализ – катализатор находится в одной фазе с субстратом. Характерным примером является
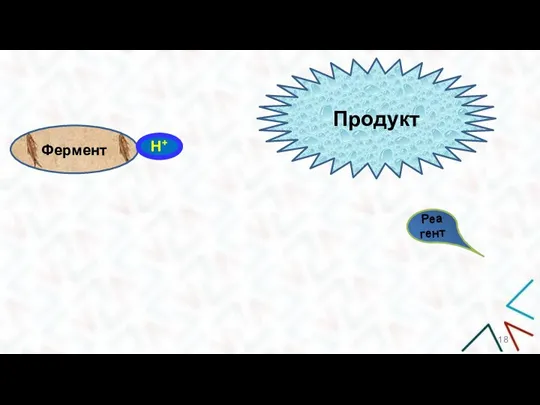
- 18. Фермент Н+ Субстрат Реагент Продукт
- 19. 2. Гетерогенный катализ – катализатор и субстрат находятся в разных фазах. Особенность таких катализаторов − наличие
- 20. 3. Ферментативный катализ (биокатализ) – ускорение биохимических реакций при участии белковых макромолекул, называемых ферментами (энзимами). Этот
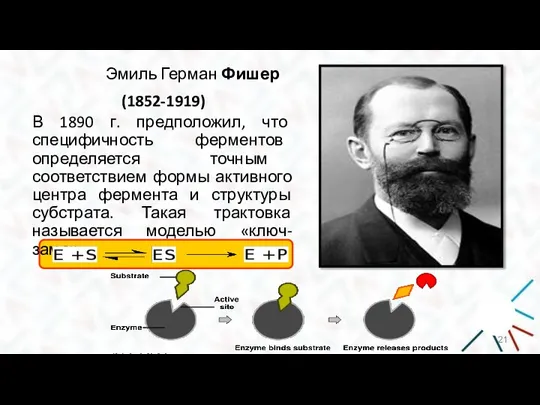
- 21. Эмиль Герман Фишер (1852-1919) В 1890 г. предположил, что специфичность ферментов определяется точным соответствием формы активного
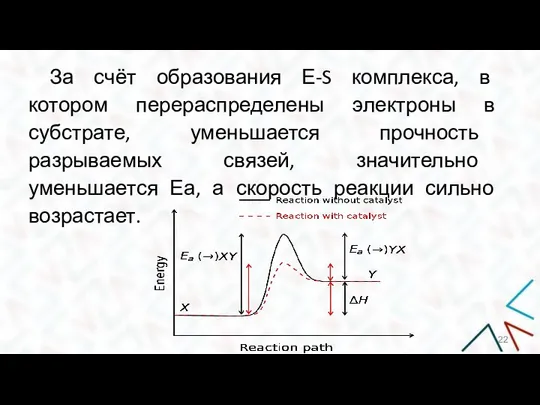
- 22. За счёт образования Е-S комплекса, в котором перераспределены электроны в субстрате, уменьшается прочность разрываемых связей, значительно
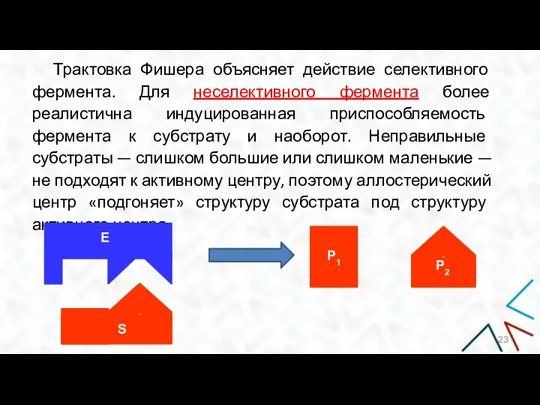
- 23. Трактовка Фишера объясняет действие селективного фермента. Для неселективного фермента более реалистична индуцированная приспособляемость фермента к субстрату
- 24. Кинетическая работа фермента Уравнение Михаэ́лиса – Ме́нтен — описывает зависимость скорости реакции, катализируемой ферментом, от концентрации
- 25. Графическое отображение уравнения Михаэлиса–Ментен При низких [S] − реакция I порядка; V=k[S] При высоких [S] −
- 26. Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение различных химических реакций. Ферментативный ингибитор
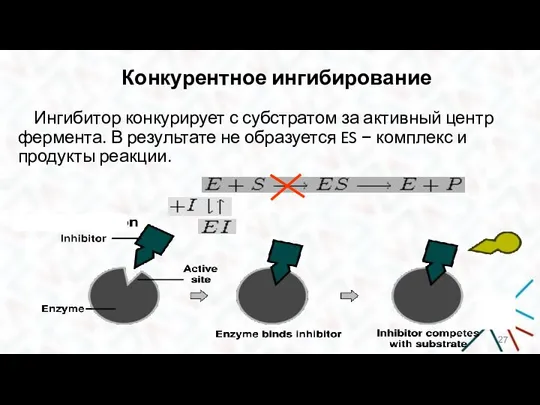
- 27. Конкурентное ингибирование Ингибитор конкурирует с субстратом за активный центр фермента. В результате не образуется ES −
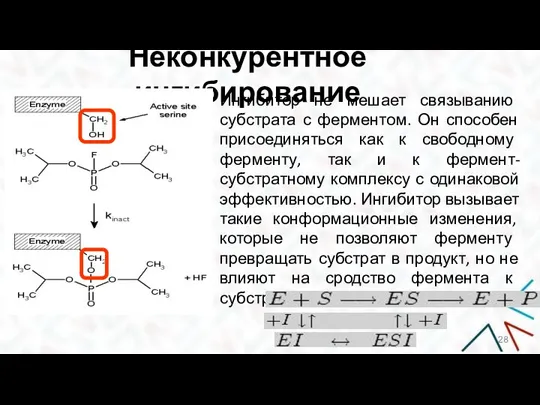
- 28. Неконкурентное ингибирование Ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту,
- 29. E I S E
- 30. ЗАКЛЮЧЕНИЕ 1.Скорость реакции всегда величина положительная и непостоянная во времени. 2.С ростом температуры увеличивается доля молекул,
- 32. Скачать презентацию


















![Графическое отображение уравнения Михаэлиса–Ментен При низких [S] − реакция I порядка; V=k[S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1181903/slide-24.jpg)



 Металлы: общая характеристика
Металлы: общая характеристика Тест- тренажер по теме: Основные классы неорганических веществ Оксиды
Тест- тренажер по теме: Основные классы неорганических веществ Оксиды Турнир знатоков химии
Турнир знатоков химии Русские ученые и топонимы в периодической системе химических элементов Д.И. Менделеева
Русские ученые и топонимы в периодической системе химических элементов Д.И. Менделеева Азотная кислота и её соли. Бесцветная жидкость. HNO3
Азотная кислота и её соли. Бесцветная жидкость. HNO3 ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Электронная структура атомов
Электронная структура атомов Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Экологические характеристики ДВС
Экологические характеристики ДВС Многообразие веществ
Многообразие веществ Валентность
Валентность История и методология химии
История и методология химии Простые вещества - неметаллы
Простые вещества - неметаллы Количество вещества. Моль
Количество вещества. Моль Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки 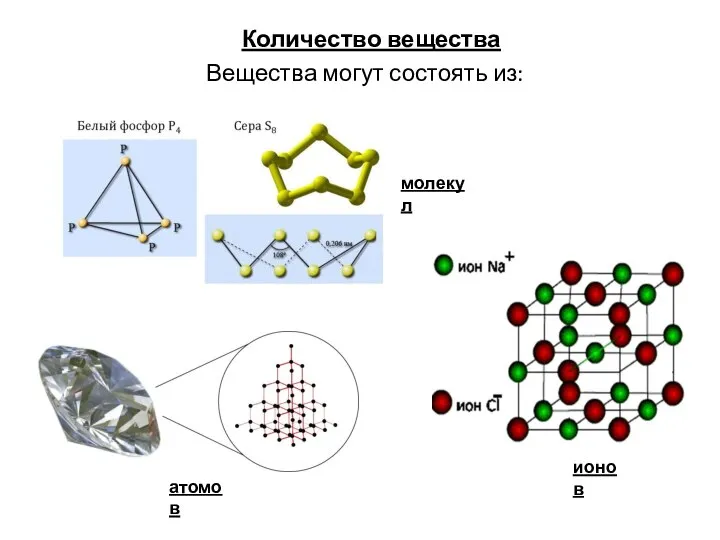 Количество вещества
Количество вещества Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Алкины
Алкины Дисперсные системы
Дисперсные системы Получение углекислого газа и изучение его свойств. Практическая работа
Получение углекислого газа и изучение его свойств. Практическая работа Презентация на тему Строение газообразных, жидких и твердых тел
Презентация на тему Строение газообразных, жидких и твердых тел  Органические реагенты
Органические реагенты Скорость химической реакции
Скорость химической реакции Презентация на тему Химия в медицине
Презентация на тему Химия в медицине  Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Химические элементы
Химические элементы Нуклеин қышқылдары
Нуклеин қышқылдары